题目内容
下表是元素周期表的一部分.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | |||
(2)某元素是空气中含量最多的元素,则该元素的元素符号是 ,其单质的电子式为 .
(3 已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质.写出元素③的氢氧化物与NaOH溶液反应的化学方程式 ,
又如表中与元素⑦的性质相似的不同族、不同周期元素X是 (填元素符号),预测X单质与冷水反应的化学方程式 .
【答案】分析:由元素所在周期表中的位置可知:①为H,②为Li,③为Be,④为B,⑤为N,⑥为O,⑦为Mg,⑧为Al,⑨为S,⑩为Cl,
(1)元素的非金属性越强,对应单质的氧化性越强,则氢化物的还原性越弱;
(2)空气中含量最多的元素为N;
(3)周期表中,处于对角线位置的元素在性质上具有相似性.
解答:解:由元素所在周期表中的位置可知:①为H,②为Li,③为Be,④为B,⑤为N,⑥为O,⑦为Mg,⑧为Al,⑨为S,⑩为Cl,则
(1)⑩为Cl,对应氢化物为HCl,根据元素的非金属性越强,对应单质的氧化性越强,则氢化物的还原性越弱,已知非金属性:Cl>S,则HCl的还原性较H2S弱,可根据反应H2S+Cl2=S+2HCl进行验证,故答案为:弱;
(2)空气中含量最多的元素为N,其单质的电子式为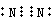 ,故答案为:N;
,故答案为:N;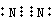 ;
;
(3)元素Be与元素Al的氢氧化物有相似的性质,处于周期表对角线位置,已知:Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3具有两性,则也具有两性,能与NaOH溶液反应生成盐和水,反应的化学方程式为Be(OH)2+2NaOH═Na2BeO2+2H2O,与元素Mg的性质相似的不同族、不同周期元素是Li,为较活泼金属,与水反应生成LiOH和氢气,
反应的化学方程式为2Li+2H2O═2LiOH+H2↑,
故答案为:Be(OH)2+2NaOH═Na2BeO2+2H2O;Li;2Li+2H2O═2LiOH+H2↑.
点评:本题考查元素周期表和周期律的应用,题目难度不大,本题注意把握元素周期表的组成,把握周期律的递变规律,易错点为(3),注意对角线规则的应用.
(1)元素的非金属性越强,对应单质的氧化性越强,则氢化物的还原性越弱;
(2)空气中含量最多的元素为N;
(3)周期表中,处于对角线位置的元素在性质上具有相似性.
解答:解:由元素所在周期表中的位置可知:①为H,②为Li,③为Be,④为B,⑤为N,⑥为O,⑦为Mg,⑧为Al,⑨为S,⑩为Cl,则
(1)⑩为Cl,对应氢化物为HCl,根据元素的非金属性越强,对应单质的氧化性越强,则氢化物的还原性越弱,已知非金属性:Cl>S,则HCl的还原性较H2S弱,可根据反应H2S+Cl2=S+2HCl进行验证,故答案为:弱;
(2)空气中含量最多的元素为N,其单质的电子式为
(3)元素Be与元素Al的氢氧化物有相似的性质,处于周期表对角线位置,已知:Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3具有两性,则也具有两性,能与NaOH溶液反应生成盐和水,反应的化学方程式为Be(OH)2+2NaOH═Na2BeO2+2H2O,与元素Mg的性质相似的不同族、不同周期元素是Li,为较活泼金属,与水反应生成LiOH和氢气,
反应的化学方程式为2Li+2H2O═2LiOH+H2↑,
故答案为:Be(OH)2+2NaOH═Na2BeO2+2H2O;Li;2Li+2H2O═2LiOH+H2↑.
点评:本题考查元素周期表和周期律的应用,题目难度不大,本题注意把握元素周期表的组成,把握周期律的递变规律,易错点为(3),注意对角线规则的应用.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目



 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是