题目内容
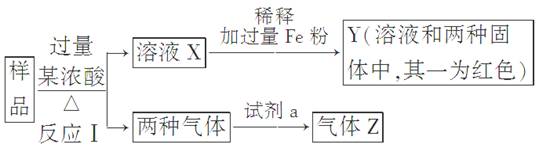
(9分)由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是____________________________________________________________
________________________________________________________________________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是________。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3 mol电子,该反应的离子方程式是________。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)________。
(1)Al'(2)①C+2H2SO4(浓)CO2↑+2SO2↑+2H2O'②NO、CO2'(3)Cu2+、Fe3+、H+'(4)2Fe2++3H2O2+4I-===2Fe(OH)3↓+2I2'(5)CuO、C或CuO、C、Fe2O3
解析:(1)加入浓酸,取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明无Al。如果有Al,加入过量的NaOH,通入CO2则会有沉淀产生。(2)Z只为一种气体,试剂a为饱和NaHCO3溶液,说明产生的气体是CO2,上述物质中应该有C,中学中常见的浓酸有浓H2SO4、浓HNO3两种,但是产生气体Z只有一种的是浓H2SO4,产生Z为两种气体的是浓HNO3。因为:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O,其中SO2可与饱和NaHCO3反应生成CO2,故气体只为CO2;C+4HNO3(浓)CO2↑+4NO2↑+2H2O,其中NO2溶于水后形成硝酸产生NO,故两种气体为NO、CO2。(3)由上面的现象知道红色固体是Cu,酸过量有氢离子,加入氯气反应,则溶液中有Fe2+转化为Fe3+,Fe3+将Cu氧化为Cu2+,氯气过量最终生成Fe3+和Cu2+。(4)KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成,有I-转化为I2,Fe2+转化为Fe(OH)3,当消耗2mol I-时,共转移3 mol电子,则H2O2转化为H2O,离子方程式为:2Fe2++3H2O2+4I-===2Fe(OH)3↓+2I2。

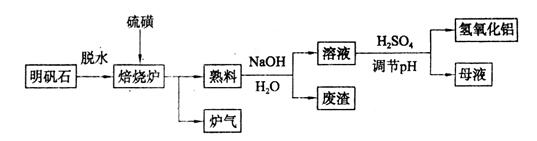
 2Al2O3+9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。
2Al2O3+9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。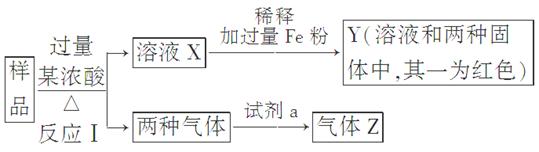
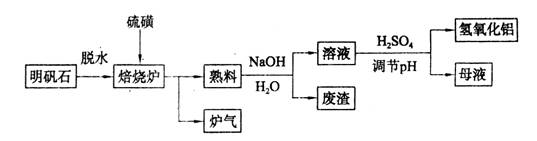
 2Al2O3+9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。
2Al2O3+9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。