题目内容
(14分) 在温度为373K时,将0.400 mol无色的N2O4气体通入4 L抽空
的密闭容器中,立刻出现红棕色,直至建立N2O4 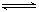 2NO2 的平
2NO2 的平
衡。右图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,
横坐标为时间)(1)该反应的化学平衡常数表达式为K = 。此温度下,K值= 。
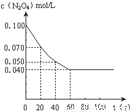
(2)计算在0至20秒时间内,NO2的平均生成速率为 mol•L-1•s-1。
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
|
T/ K |
323 |
373 |
|
K值 |
0.022 |
? |
据此可推测该反应(生成NO2)是 反应(选填“吸热”或“放热”)。
(4)若其他条件不变,反应在373K时达到平衡后,将N2O4和NO2的浓度都增加至0.4mol/L,平衡将向 (填“正”或“逆”)反应方向移动。
(5) 反应在373K时达到平衡时,N2O4的转化率=_________________,若将反应容器的容积缩小为原来的一半,则N2O4的转化率将_________(选填“增大”,“减小”或“不变”)
(1)K = 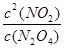 ;K值=
0.36 。(1)0.003mol•L-1•s-1。
;K值=
0.36 。(1)0.003mol•L-1•s-1。
(3) 吸热 反应(填“吸热”或“放热”)。 (4)向 逆 (填“正”或“逆”)反应方向移动。
(5)60%,减小
【解析】考查可逆反应的有关
(1)在一定条件下,当可逆反应达到化学平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,称为化学平衡常数。所以该反应的平衡常数表达式为K =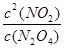 。根据图像可知,平衡时N2O4的浓度为0.040mol/L,起始时N2O4的浓度为0.100mol/L,所以其浓度变化量为0.060mol/L,因此平衡时NO2的浓度为0.12mol/L。所以平衡常数为
。根据图像可知,平衡时N2O4的浓度为0.040mol/L,起始时N2O4的浓度为0.100mol/L,所以其浓度变化量为0.060mol/L,因此平衡时NO2的浓度为0.12mol/L。所以平衡常数为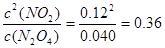 。
。
(2)根据图像可知,20s时N2O4的浓度为0.070mol/L,所以其浓度变化量为0.030mol/L,因此此时NO2的浓度为0.06mol/L。所以NO2的反应速率为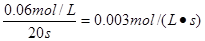 。
。
(3)根据平衡常数的数值可知温度越高,平衡常数越大,所以正反应是吸热反应。
(4)若N2O4和NO2的浓度都是0.4mol/L,则此时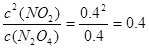 >0.36,这说明此时逆反应速率大于正反应速率,反应向逆反应方向移动。
>0.36,这说明此时逆反应速率大于正反应速率,反应向逆反应方向移动。
(5)根据(1)可知N2O4的转化率为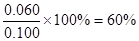 。因为反应是体积增大的可逆反应,所以增大压强,平衡向逆反应方向移动,转化率减小。
。因为反应是体积增大的可逆反应,所以增大压强,平衡向逆反应方向移动,转化率减小。

(14分) 在温度为373K时,将0.400 mol无色的N2O4气体通入4 L抽空
的密闭容器中,立刻出现红棕色,直至建立N2O4  2NO2 的平
2NO2 的平
衡。右图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,
横坐标为时间)(1)该反应的化学平衡常数表达式为K = 。此温度下,K值= 。
(2)计算在0至20秒时间内,NO2的平均生成速率为 mol?L-1?s-1。
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
| T/ K | 323 | 373 |
| K值 | 0.022 | ? |
(4)若其他条件不变,反应在373K时达到平衡后,将N2O4和NO2的浓度都增加至0.4mol/L,平衡将向 (填“正”或“逆”)反应方向移动。
(5) 反应在373K时达到平衡时,N2O4的转化率=_________________,若将反应容器的容积缩小为原来的一半,则N2O4的转化率将_________(选填“增大”,“减小”或“不变”)
(14分) 对于反应A(g) 2B(g) DH>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。回答下列各题。

(1)根据曲线图,分析下列说法正确的是 ▲ (填字母) 。
A.a、c两点的反应速率:a 〉c
B.由状态b到状态a,可以通过加热的方法
C.b、c两点A气体的转化率相等
(2)上述反应在密闭容器(定容)中进行,达到平衡状态的标志是 ▲ (填字母) 。
A.单位时间内生成n mol A的同时分解2n molB
B.两种气体的体积分数不再改变
C.v正(A)=2v逆(B)
D.混合气体的密度不再发生变化
E.混合气体的压强不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1 mol·L-1 ,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度 ▲ 0.1 mol·L-1(填“〉”、“〈”或“=”) 。
(4)在100℃时,将0.40mol的B气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
|
n(B)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
|
n(A)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
① 在上述条件下,从反应开始至40s时,以A气体表示的该反应的平均反应速率为 ▲ ;
② 上表中n3 ▲ n4(填“〉”、“〈”或“=”),反应A(g) 2B(g)在100℃时的平衡常数K的值为 ▲ ,升高温度后,反应2B(g) A(g)的平衡常数K的值 ▲ (填“增大”、“减小”或“不变”);
③ 若在相同情况下最初向该容器中充入的是A气体,要达到上述同样的平衡状态,A气体的起始浓度为 ▲ mol·L-1 。
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq) a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)