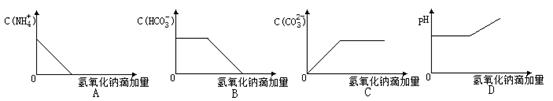
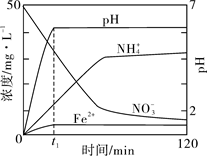
题目内容
某强酸性溶液X中含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的一种或几种离子,取该溶液进行连续实验,能实现如下转化:
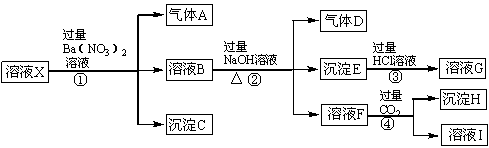
根据以上信息,请回答下列问题:
(1)溶液X中除H+外肯定含有的离子是 ,不能确定是否含有的离子是 ,若要确定不能确定的阳离子是否存在,最可靠方法是:
。
(2)沉淀E的化学式为 。
(3)反应①、②、③、④中,属于氧化还原反应的是 (填序号)
(4)写出步骤①中生成气体A的离子方程式: 。

根据以上信息,请回答下列问题:
(1)溶液X中除H+外肯定含有的离子是 ,不能确定是否含有的离子是 ,若要确定不能确定的阳离子是否存在,最可靠方法是:
。
(2)沉淀E的化学式为 。
(3)反应①、②、③、④中,属于氧化还原反应的是 (填序号)
(4)写出步骤①中生成气体A的离子方程式: 。
(1)Al3+、NH4+、Fe2+、SO42-;Fe3+;取少量X溶液于试管中,加入几滴KSCN溶液,溶液颜色变红,则证明含有Fe3+,若不变红,则表明不含Fe3+。
(2)Fe(OH)3
(3)①
(4)3Fe2++NO3-+4H+=3Fe3++NO↑+H2O
试题分析:某强酸性溶液可以排除掉SiO32-、CO32-的存在,加入过量的硝酸钡沉液产生气体A和沉淀B,可以确定一定含有SO42-、Fe2+,一定不含有NO3-,加入过量的氢氧化钠能产生气体,可以确定一定含有NH4+。

练习册系列答案
相关题目
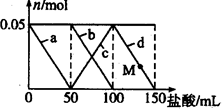
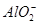 的减少,d曲线表示氢氧化铝的溶解
的减少,d曲线表示氢氧化铝的溶解 与
与