题目内容
工业纯碱主要含有NaCl和NaHCO3杂质,为了鉴定纯碱的含量,常用酸碱滴定法测定总碱度,反应产物为NaCl、CO2和H2O。当盐酸与一定量工业纯碱恰好完全反应时,溶液pH为3.8~3.9(滴定时NaHCO3也被中和)。工业纯碱的总碱度测定值通常以Na2CO3%或Na2O%表示。主要实验步骤:①准确称取工业纯碱试样2.00 g;②用适量水配制成体积一定的溶液;③准确称取一定量的所配试液,再用0.01 mol·L-1盐酸标准滴定,测其总碱度。请回答以下问题:
(1)称取固体工业纯碱试样时,为什么试样取量尽量多些并且力求均匀?
____________________________________。
(2)在准确称取纯碱试样后,为继续进行实验,除选用烧杯、玻璃棒、酸式滴定管、碱式滴定管、锥形瓶之外,还需要的仪器用品(试剂除外)有___________ 。
(3)在滴定操作中,应选用的指示剂是___________。
(4)假如所称取的纯碱试样中,除含有2%的NaCl外,另外的杂质中只有NaHCO3,那么NaHCO3含量的大小对该试样总碱度的测定值有何影响?
解析:当pH=3.8~3.9时,NaHCO3与HCl反应生成NaCl和H2O,因此应选用甲基橙作指示剂。
答案:(1)固体样品中杂质分布不一定均匀,因此取样时尽量将固体混合均匀,且取量多时,误差小,使测定结果更准确
(2)容量瓶、胶头滴管、滴定台(铁架台、滴定管夹)
(3)甲基橙
(4)NaHCO3越多,总碱度值越小。

练习册系列答案
相关题目
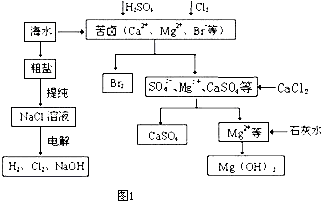
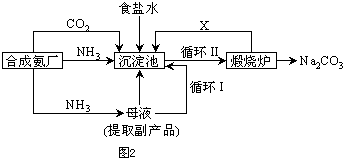

 NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________
NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________ 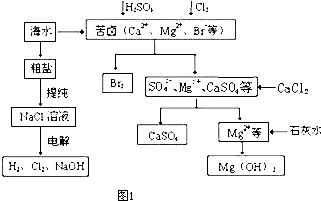


 CO2+H2
CO2+H2