题目内容
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,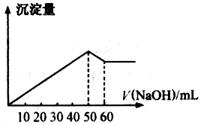
则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )
| A.6:1 | B.3:1 | C.2:1 | D.1:2 |
D
解析试题分析:氢氧化铝是两性氢氧化物,能溶于氢氧化钠溶液中,而氢氧化镁不能。反应的有关方程式是Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O↓。所以根据图像可知溶解氢氧化铝消耗的氢氧化钠是10ml,所以生成氢氧化铝消耗的氢氧化钠就应该是30ml,则生成氢氧化镁消耗的氢氧化钠是20ml。所以根据反应的方程式可知,铝离子和镁离子的物质的量之比是1︰1。则则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为1︰2,答案选D。
考点:考查氢氧化铝制备的有关计算
点评:该题的关键是根据方程式得出溶解氢氧化铝消耗的氢氧化钠和生成氢氧化铝消耗的氢氧化钠的关系式,然后再依据图像进行计算即可。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



