题目内容
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
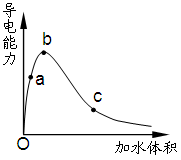

| A.a、b、c三点溶液的pH:c<a<b |
| B.a、b、c三点醋酸的电离程度:a<b<c |
| C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小 |
| D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b |
BC
根据溶液的导电能力可知,氢离子浓度由大到小的顺序是bac,所以pH由大到小的顺序是cab,A不正确;稀释促进电离,选项B正确;pH试纸如果事先润湿,则相当于稀释醋酸,由于a点随溶液的稀释氢离子浓度是增大的,所以pH会减小,C正确;醋酸在稀释过程中,醋酸的物质的量是不变的,中和氢氧化钠的能力是不变的,D不正确,答案选BC。

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目