题目内容
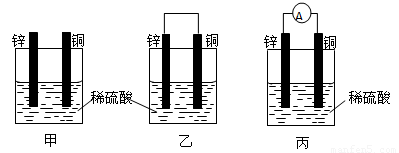
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察锌片上有气泡,再平行插入一块铜片,可观察到铜片 (填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来,组成一个原电池,负极为 ,正极的电极反应式为 ;
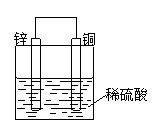
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见下图,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内 溶液中硫酸的物质的量浓度为(溶液体积变化忽略不计) ;
(3)生活中利用原电池原理生产了各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其最主要原因是 。
A、回收利用电池外壳的金属
B、防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
C、防止电池中渗泄的电解液腐蚀其他物品
D、回收其中石墨电极
![]()
(1)没有(1分) 锌(1分) 2H++2e-=H2 ↑(2分)
(2) 1.0 mol/L(2分)(3)B(2分)
![]()

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目


 人们把它叫做原电池。
人们把它叫做原电池。