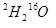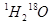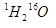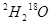题目内容
已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中正确的是
| A.硒的原子序数为34 | B.硒的氢化物比HBr稳定 |
| C.硒的非金属性 比硫强 | D.硒的最高价氧化物的水化物显碱性 |
A
试题分析:已知S的原子叙述为16,而第四周期有18个元素,硒与氧、硫同主族,所以硒的原子序数为16+18=34,故A正确;根据同一周期非金属活动性从左到右逐渐增强,可以知道硒的氢化物比HBr不稳定,所以B错误;根据同一主族元素的非金属性从上到下减弱可以知道,硒的非金属性比硫弱,所以C错误;硒的最高价氧化物的水化物为硒酸,显示出酸性,故D错误。
点评:本题考查了元素周期表,元素周期律的相关知识,该考点是高考考查的重点和难点,本题有一定的综合性,难度适中。

练习册系列答案
相关题目
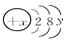
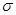 ”“
”“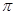 ”)。
”)。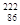 Rn,从而对人体产生伤害该同位素原子的中子数和质子数之差是( )
Rn,从而对人体产生伤害该同位素原子的中子数和质子数之差是( )