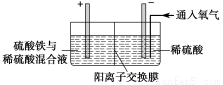
题目内容
(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是 。
(2)A、B两种气体组成的混合气体8.6 g,在标准状况下体积为8.96 L。已知A与B的物质的量之比为3∶1,相对分子质量之比为14∶1,由此可推断A可能是 ,B可能是 。
(3)在标准状况下,CO和CO2的混合气体质量为36 g,体积为22.4 L,则CO所占的体积是 L,质量是 g。
(1)XY3 (2)N2(或CO或C2H4) H2 (3)11.2 14
【解析】(1)根据阿伏加德罗定律可写出化学方程式:X2+3Y2=2Z,再根据质量守恒定律,可得Z的化学式应为XY3。
(2)由题意可得:n(A)+n(B)=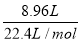 =0.4 mol,则3n(B)+n(B)=0.4 mol,即n(B)=0.1 mol,n(A)=0.3 mol。
=0.4 mol,则3n(B)+n(B)=0.4 mol,即n(B)=0.1 mol,n(A)=0.3 mol。
设B的相对分子质量为Mr,则A的相对分子质量为14Mr。
0.3×14Mr+0.1×Mr=8.6,解得Mr=2,则A、B的相对分子质量分别为28、2,A可能为N2、C2H4或CO,B可能是H2。
(3)由题意列方程组得

解得:n(CO)=0.5 mol,n(CO2)=0.5 mol
故V(CO)=11.2 L,m(CO)=14 g。

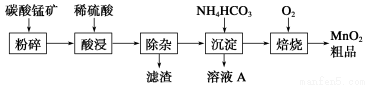
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
请回答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是__________________。
(2)酸浸后的溶液中含有Mn2+、SO42—,另含有少量Fe2+、Fe3+、Al3+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为__________________________。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是
_____________________________________________________________。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去______________________。
(3)从溶液A中回收的主要物质是________________,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式:______________________________。
工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0 | 0.20 |
| 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。