��Ŀ����
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
��1����֪��2SO2��g��+O2��g��
2SO3��g����H=-196.6kJ?mol-1
2NO��g��+O2��g��
2NO2��g����H=-113.0kJ?mol-1
��ӦNO2��g��+SO2��g��
SO3��g��+NO��g���ġ�H=
��2��һ�������£���1molNO2��2molSO2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ��� c����ϵ�����ܶȲ�����
d��ÿ����1mol SO3��ͬʱ����1molNO2 e��SO2��NO������ȱ��ֲ���
���������Ӧƽ��ʱNO2��SO2�����Ϊ1��6����ƽ�ⳣ��K=
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO��g��+2H2��g��
CH3OH��g����
�ٸ÷�Ӧ��40���60��ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1����K2����÷�ӦΪ
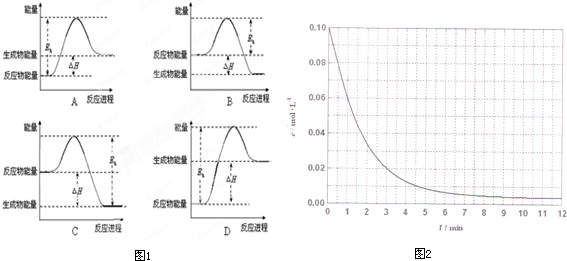
�ڸ÷�Ӧ���ʱ�Ϊ��H�����ΪE0������������ϵͼ��ͼ1����������
��4��ij�¶�ʱ�����ݵ�H2Ũ����ʱ��ı仯���ߣ�����ͬһͼ��ͼ2���л��CH2OHŨ����ʱ��ı仯���ߣ�
��1����֪��2SO2��g��+O2��g��
2NO��g��+O2��g��
��ӦNO2��g��+SO2��g��
=-41.8
=-41.8
kJ?mol-1����2��һ�������£���1molNO2��2molSO2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����
b
b
��a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ��� c����ϵ�����ܶȲ�����
d��ÿ����1mol SO3��ͬʱ����1molNO2 e��SO2��NO������ȱ��ֲ���
���������Ӧƽ��ʱNO2��SO2�����Ϊ1��6����ƽ�ⳣ��K=
2.7
2.7
��NO2��ת����=80%
80%
����3��CO�����ںϳɼ״�����Ӧ����ʽΪCO��g��+2H2��g��
�ٸ÷�Ӧ��40���60��ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1����K2����÷�ӦΪ
����
����
��Ӧ��������ȡ������ȡ����ڸ÷�Ӧ���ʱ�Ϊ��H�����ΪE0������������ϵͼ��ͼ1����������
B
B
����4��ij�¶�ʱ�����ݵ�H2Ũ����ʱ��ı仯���ߣ�����ͬһͼ��ͼ2���л��CH2OHŨ����ʱ��ı仯���ߣ�

��������1�������Ȼ�ѧ����ʽ��˹���ɼ���õ���
��2��ƽ���־�����淴Ӧ������ͬ�����ɷ��Ѷȱ��ֲ������ѡ�����ƽ�ⳣ����ת���ʸ����������õ���
��3��������ƽ�ⳣ�����¶ȱ仯��ƽ�ⳣ��Խ��ƽ��������У��¶�Խ��ƽ�������ȷ�Ӧ������У�
�ڷ����жϷ�Ӧ�Ƿ��ȷ�Ӧ����Ӧ����������������ʱ��Ƿ�Ӧ���������֮���������ֵ��仯�����أ�
��4��ij�¶�ʱ������H2Ũ����ʱ��ı仯���ߣ�����Ũ�ȼ�С��ƽ�ⲻ�䣬�״�Ũ������ƽ�ⲻ�䣬�������ʵ����ı仯���CH2OHŨ����ʱ��ı仯���ߣ�
��2��ƽ���־�����淴Ӧ������ͬ�����ɷ��Ѷȱ��ֲ������ѡ�����ƽ�ⳣ����ת���ʸ����������õ���
��3��������ƽ�ⳣ�����¶ȱ仯��ƽ�ⳣ��Խ��ƽ��������У��¶�Խ��ƽ�������ȷ�Ӧ������У�
�ڷ����жϷ�Ӧ�Ƿ��ȷ�Ӧ����Ӧ����������������ʱ��Ƿ�Ӧ���������֮���������ֵ��仯�����أ�
��4��ij�¶�ʱ������H2Ũ����ʱ��ı仯���ߣ�����Ũ�ȼ�С��ƽ�ⲻ�䣬�״�Ũ������ƽ�ⲻ�䣬�������ʵ����ı仯���CH2OHŨ����ʱ��ı仯���ߣ�
����⣺��1����2SO2��g��+O2��g��
2SO3��g����H=-196.6kJ?mol-1
��2NO��g��+O2��g��
2NO2��g����H=-113.0kJ?mol-1
���ݸ�˹����
�õ��Ȼ�ѧ����ʽΪ��NO2��g��+SO2��g��
SO3��g��+NO��g����H=-41.8KJ/mol��
�ʴ�Ϊ��-41.8��
��2��a����Ӧǰ������������䣬��Ӧ��������ϵѹǿʼ�ձ��ֲ��䣬����֤����Ӧ�ﵽƽ�⣬��a����
b��ƽ����ϵ�ж������������Ǻ���ɫ���壬���������ɫ���ֲ��䣬˵����������Ũ�Ȳ��䣬֤����Ӧ�ﵽƽ�⣬��b��ȷ��
c����Ӧǰ�������������䣬������䣬��Ӧ��������ϵ�������ܶȲ��䣬������ϵ�����ܶȲ��䲻��֤����Ӧ�ﵽƽ�⣬��c����
d��ÿ����1mol SO3��ͬʱ����1molNO2��˵����Ӧ������У�����֤����Ӧ�ﵽƽ�⣬��d����
e��SO3��NO�����֮�ȱ��ֲ��䣬�ڷ�Ӧ������ʼ����1��1������˵����Ӧ�ﵽƽ�⣬��e����
��ѡb��
һ�������£���1molNO2��2molSO2�����ܱ������з���������Ӧ��NO2��g��+SO2��g��
SO3��g��+NO��g����H=-41.8KJ/mol�����������Ӧƽ��ʱNO2��SO2�����Ϊ1��6�����ݻ�ѧƽ������ʽ��ʽ���㣬����������������ʵ���Ϊx��
NO2��g��+SO2��g��
SO3��g��+NO��g��
��ʼ����mol�� 1 2 0 0
�仯����mol�� x x x x
ƽ������mol��1-x 2-x x x
��1-x������2-x��=1��6
x=0.8mol�����������Ϊ1L��ƽ��Ũ��c��NO2��=0.2mol/L��c��SO2��=1.2mol/L��c��SO��=0.8mol/L��c��NO��=0.8mol/L��
��ƽ�ⳣ��K
=
=2.7��
����������ת����=
��100%=80%
�ʴ�Ϊ��b��2.7��80%��
��3����Ӧ����ʽΪCO��g��+2H2��g��
CH3OH��g��
�ٸ÷�Ӧ��40���60��ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1����K2��˵���¶�����ƽ�ⳣ����С��ƽ��������У�����Ӧ�Ƿ��ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
�ڷ�Ӧ�Ƿ��ȷ�Ӧ����Ӧ����������������ʱ��Ƿ�Ӧ���������֮���������ֵ��
A����Ӧ���������������ﷴӦ�����ȷ�Ӧ����A����
B����Ӧ�����������������Ƿ��ȷ�Ӧ���ʱ���ϣ����������Ӧ�Ļ�ܣ���B��ȷ��
C����Ӧ�����������������Ƿ��ȷ�Ӧ���ʱ���ϣ���ܲ�������Ӧ�Ļ�ܣ���C����
D����Ӧ���������������ﷴӦ�����ȷ�Ӧ����D����
�ʴ�Ϊ��B��
��4��ij�¶�ʱ������ͼ���е�H2Ũ����ʱ��ı仯���ߣ�����Ũ�ȼ�С��ƽ�ⲻ�䣬�״�Ũ������ƽ�ⲻ�䣬����������Ũ�Ⱥͻ�ѧ����ʽ����״�Ũ�ȵ�������㻭��ͼ��0.01��0.02����0.02��0.04����0.03��0.06������0.04��0.08�����CH2OHŨ����ʱ��ı仯����Ϊ��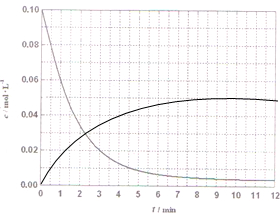 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2NO��g��+O2��g��
���ݸ�˹����
| ��-�� |
| 2 |
�ʴ�Ϊ��-41.8��
��2��a����Ӧǰ������������䣬��Ӧ��������ϵѹǿʼ�ձ��ֲ��䣬����֤����Ӧ�ﵽƽ�⣬��a����
b��ƽ����ϵ�ж������������Ǻ���ɫ���壬���������ɫ���ֲ��䣬˵����������Ũ�Ȳ��䣬֤����Ӧ�ﵽƽ�⣬��b��ȷ��
c����Ӧǰ�������������䣬������䣬��Ӧ��������ϵ�������ܶȲ��䣬������ϵ�����ܶȲ��䲻��֤����Ӧ�ﵽƽ�⣬��c����
d��ÿ����1mol SO3��ͬʱ����1molNO2��˵����Ӧ������У�����֤����Ӧ�ﵽƽ�⣬��d����
e��SO3��NO�����֮�ȱ��ֲ��䣬�ڷ�Ӧ������ʼ����1��1������˵����Ӧ�ﵽƽ�⣬��e����
��ѡb��
һ�������£���1molNO2��2molSO2�����ܱ������з���������Ӧ��NO2��g��+SO2��g��
NO2��g��+SO2��g��
��ʼ����mol�� 1 2 0 0
�仯����mol�� x x x x
ƽ������mol��1-x 2-x x x
��1-x������2-x��=1��6
x=0.8mol�����������Ϊ1L��ƽ��Ũ��c��NO2��=0.2mol/L��c��SO2��=1.2mol/L��c��SO��=0.8mol/L��c��NO��=0.8mol/L��
��ƽ�ⳣ��K
| c(SO3)c(NO) |
| c(NO2)c(SO2) |
| 0.8��0.8 |
| 0.2��1.2 |
����������ת����=
| 0.8mol |
| 1mol |
�ʴ�Ϊ��b��2.7��80%��
��3����Ӧ����ʽΪCO��g��+2H2��g��
�ٸ÷�Ӧ��40���60��ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1����K2��˵���¶�����ƽ�ⳣ����С��ƽ��������У�����Ӧ�Ƿ��ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
�ڷ�Ӧ�Ƿ��ȷ�Ӧ����Ӧ����������������ʱ��Ƿ�Ӧ���������֮���������ֵ��
A����Ӧ���������������ﷴӦ�����ȷ�Ӧ����A����
B����Ӧ�����������������Ƿ��ȷ�Ӧ���ʱ���ϣ����������Ӧ�Ļ�ܣ���B��ȷ��
C����Ӧ�����������������Ƿ��ȷ�Ӧ���ʱ���ϣ���ܲ�������Ӧ�Ļ�ܣ���C����
D����Ӧ���������������ﷴӦ�����ȷ�Ӧ����D����
�ʴ�Ϊ��B��
��4��ij�¶�ʱ������ͼ���е�H2Ũ����ʱ��ı仯���ߣ�����Ũ�ȼ�С��ƽ�ⲻ�䣬�״�Ũ������ƽ�ⲻ�䣬����������Ũ�Ⱥͻ�ѧ����ʽ����״�Ũ�ȵ�������㻭��ͼ��0.01��0.02����0.02��0.04����0.03��0.06������0.04��0.08�����CH2OHŨ����ʱ��ı仯����Ϊ��
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�����������⿼�����Ȼ�ѧ����ʽ��˹���ɼ���Ӧ�ã���ѧƽ��Ӱ�����صķ����жϣ���ѧƽ��ļ���Ӧ�ã�ͼ��������ƣ���Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
 ��2011?ɽ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮
��2011?ɽ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮 ���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش���������
���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش��������� �о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮