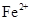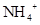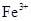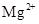题目内容
(15分)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示:

由此可知,(1)该溶液中肯定含有的阳离子是____________________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是___________;检验可能含有的某种阳离子的常用实验方法是 ;
(2)分别写出BC、CD段对应的离子方程式,并写出BC段参加反应的阳离子在实验室中常用的检验其存在的方法:BC:________________________________________;
检验:_____________________________________________;
CD:__________________________________________.

由此可知,(1)该溶液中肯定含有的阳离子是____________________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是___________;检验可能含有的某种阳离子的常用实验方法是 ;
(2)分别写出BC、CD段对应的离子方程式,并写出BC段参加反应的阳离子在实验室中常用的检验其存在的方法:BC:________________________________________;
检验:_____________________________________________;
CD:__________________________________________.
⑴H+、Al3+、NH4+(2分); 2∶1∶3(2分);Mg2+、Fe3+(2分);焰色反应(2分)。
⑵NH4++OH- NH3·H2O(或NH4++OH- =NH3↑+H2O)(2分); 取少量未知试液于试管中,滴加氢氧化钠溶液后加热,如果产生有刺激性气味的气体,且该气体能使湿润的红色石蕊试纸变蓝,则证明原待测液中有NH4+存在(或该气体遇到沾有浓盐酸的玻璃棒有白烟现象也能证明NH4+存在)(3分);
NH3·H2O(或NH4++OH- =NH3↑+H2O)(2分); 取少量未知试液于试管中,滴加氢氧化钠溶液后加热,如果产生有刺激性气味的气体,且该气体能使湿润的红色石蕊试纸变蓝,则证明原待测液中有NH4+存在(或该气体遇到沾有浓盐酸的玻璃棒有白烟现象也能证明NH4+存在)(3分);
Al(OH)3+OH- =AlO2-+2H2O(2分)
⑵NH4++OH-
 NH3·H2O(或NH4++OH- =NH3↑+H2O)(2分); 取少量未知试液于试管中,滴加氢氧化钠溶液后加热,如果产生有刺激性气味的气体,且该气体能使湿润的红色石蕊试纸变蓝,则证明原待测液中有NH4+存在(或该气体遇到沾有浓盐酸的玻璃棒有白烟现象也能证明NH4+存在)(3分);
NH3·H2O(或NH4++OH- =NH3↑+H2O)(2分); 取少量未知试液于试管中,滴加氢氧化钠溶液后加热,如果产生有刺激性气味的气体,且该气体能使湿润的红色石蕊试纸变蓝,则证明原待测液中有NH4+存在(或该气体遇到沾有浓盐酸的玻璃棒有白烟现象也能证明NH4+存在)(3分);Al(OH)3+OH- =AlO2-+2H2O(2分)
试题分析:(1)根据图像可知,最初没有沉淀生成,所以一定含有氢离子。当沉淀达到最大值时,继续加入氢氧化钠,沉淀不发生变化,说明还含有NH4+。根据沉淀溶解时消耗的氢氧化钠溶液体积和生成沉淀时消耗的氢氧化钠溶液体积可知,二者是1︰3,这么说沉淀只有氢氧化铝,没有氢氧化镁、氢氧化铁,所以一定含有Al3+,但没有Mg2+、Fe3+。根据溶液的电中性可知,一定还在SO42-,但钠离子并能确定,检验钠离子可以通过焰色反应确定。根据图像中消耗氢氧化钠溶液的体积,并结合反应式H++OH-=H2O、OH-+3OH-=Al(OH)3↓、NH4++OH-=NH3·H2O可知,H+、Al3+、NH4+的物质的量之比2∶1∶3。
(2)BC段是铵盐和强碱的反应,所以反应的化学方程式是NH4++OH-
 NH3·H2O。依据该实验原理可以检验NH4+,即取少量未知试液于试管中,滴加氢氧化钠溶液后加热,如果产生有刺激性气味的气体,且该气体能使湿润的红色石蕊试纸变蓝,则证明原待测液中有NH4+存在(或该气体遇到沾有浓盐酸的玻璃棒有白烟现象也能证明NH4+存在)。而CD段是溶解氢氧化铝的,所以反应的方程式是Al(OH)3+OH- =AlO2-+2H2O。4+的有关检验
NH3·H2O。依据该实验原理可以检验NH4+,即取少量未知试液于试管中,滴加氢氧化钠溶液后加热,如果产生有刺激性气味的气体,且该气体能使湿润的红色石蕊试纸变蓝,则证明原待测液中有NH4+存在(或该气体遇到沾有浓盐酸的玻璃棒有白烟现象也能证明NH4+存在)。而CD段是溶解氢氧化铝的,所以反应的方程式是Al(OH)3+OH- =AlO2-+2H2O。4+的有关检验点评:进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。

练习册系列答案
相关题目

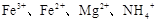 的水溶液中,加入足量的
的水溶液中,加入足量的 固体,充分反应后再加入过量的稀盐酸,上述离子数目没有变化的是( )
固体,充分反应后再加入过量的稀盐酸,上述离子数目没有变化的是( )