题目内容
配制一定物质的量浓度的氢氧化钠标准溶液,用于测定未知浓度的盐酸,下列操作中会造成所测盐酸浓度偏低的是
- A.所用烧碱已部分潮解
- B.称量时砝码放在左盘,并移动游码
- C.定容后,溶液液面最高点与刻度线处在同一水平面上
- D.向容量瓶中一次性转移氢氧化钠溶液
C
分析:根据c(HCl)=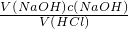 可知,影响盐酸浓度测定的因素有溶液体积(氢氧化钠溶液与盐酸体积)、氢氧化钠的浓度.取一定体积盐酸用所配氢氧化钠溶液滴定,盐酸中氯化氢是一定的,所配氢氧化钠溶液的浓度低,会导致滴定所用氢氧化钠溶液的体积偏大,测量盐酸的浓度偏大;所配氢氧化钠溶液的浓度高,会导致滴定所用氢氧化钠溶液的体积偏小,测量盐酸的浓度偏低.由选项可知,各操作为氢氧化钠溶液的配制,分析操作对溶质的物质的量或溶液的体积的影响,根据c=
可知,影响盐酸浓度测定的因素有溶液体积(氢氧化钠溶液与盐酸体积)、氢氧化钠的浓度.取一定体积盐酸用所配氢氧化钠溶液滴定,盐酸中氯化氢是一定的,所配氢氧化钠溶液的浓度低,会导致滴定所用氢氧化钠溶液的体积偏大,测量盐酸的浓度偏大;所配氢氧化钠溶液的浓度高,会导致滴定所用氢氧化钠溶液的体积偏小,测量盐酸的浓度偏低.由选项可知,各操作为氢氧化钠溶液的配制,分析操作对溶质的物质的量或溶液的体积的影响,根据c= 判断不当操作对所配溶液浓度影响,据此判断.
判断不当操作对所配溶液浓度影响,据此判断.
解答:A、所用烧碱已部分潮解,实际称量的氢氧化钠减少,所配氢氧化钠溶液浓度偏低,会导致滴定所用氢氧化钠溶液的体积偏大,测量盐酸的浓度偏大,故A不符合;
B、称量时砝码放在左盘,并移动游码,实际称量的氢氧化钠减少,所配氢氧化钠溶液浓度偏低,会导致滴定所用氢氧化钠溶液的体积偏大,测量盐酸的浓度偏大,故B不符合;
C、定容后,溶液液面最高点与刻度线处在同一水平面上,所配氢氧化钠溶液的体积偏小,氢氧化钠溶液浓度偏大,会导致滴定所用氢氧化钠溶液的体积偏小,测量盐酸的浓度偏低,故C符合;
D、向容量瓶中一次性转移氢氧化钠溶液,未洗涤烧杯、玻璃棒,溶液容量瓶中氢氧化钠的质量减小,所配氢氧化钠溶液的浓度偏小,会导致滴定所用氢氧化钠溶液的体积偏大,测量盐酸的浓度偏大,故D不符合.
故选C.
点评:本题考查中和滴定、配制一定物质的量浓度溶液误差分析,难度中等,根据c(HCl)=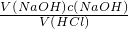 判断所配氢氧化钠溶液的浓度对盐酸浓度测量的影响是关键.
判断所配氢氧化钠溶液的浓度对盐酸浓度测量的影响是关键.
分析:根据c(HCl)=
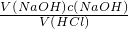 可知,影响盐酸浓度测定的因素有溶液体积(氢氧化钠溶液与盐酸体积)、氢氧化钠的浓度.取一定体积盐酸用所配氢氧化钠溶液滴定,盐酸中氯化氢是一定的,所配氢氧化钠溶液的浓度低,会导致滴定所用氢氧化钠溶液的体积偏大,测量盐酸的浓度偏大;所配氢氧化钠溶液的浓度高,会导致滴定所用氢氧化钠溶液的体积偏小,测量盐酸的浓度偏低.由选项可知,各操作为氢氧化钠溶液的配制,分析操作对溶质的物质的量或溶液的体积的影响,根据c=
可知,影响盐酸浓度测定的因素有溶液体积(氢氧化钠溶液与盐酸体积)、氢氧化钠的浓度.取一定体积盐酸用所配氢氧化钠溶液滴定,盐酸中氯化氢是一定的,所配氢氧化钠溶液的浓度低,会导致滴定所用氢氧化钠溶液的体积偏大,测量盐酸的浓度偏大;所配氢氧化钠溶液的浓度高,会导致滴定所用氢氧化钠溶液的体积偏小,测量盐酸的浓度偏低.由选项可知,各操作为氢氧化钠溶液的配制,分析操作对溶质的物质的量或溶液的体积的影响,根据c= 判断不当操作对所配溶液浓度影响,据此判断.
判断不当操作对所配溶液浓度影响,据此判断.解答:A、所用烧碱已部分潮解,实际称量的氢氧化钠减少,所配氢氧化钠溶液浓度偏低,会导致滴定所用氢氧化钠溶液的体积偏大,测量盐酸的浓度偏大,故A不符合;
B、称量时砝码放在左盘,并移动游码,实际称量的氢氧化钠减少,所配氢氧化钠溶液浓度偏低,会导致滴定所用氢氧化钠溶液的体积偏大,测量盐酸的浓度偏大,故B不符合;
C、定容后,溶液液面最高点与刻度线处在同一水平面上,所配氢氧化钠溶液的体积偏小,氢氧化钠溶液浓度偏大,会导致滴定所用氢氧化钠溶液的体积偏小,测量盐酸的浓度偏低,故C符合;
D、向容量瓶中一次性转移氢氧化钠溶液,未洗涤烧杯、玻璃棒,溶液容量瓶中氢氧化钠的质量减小,所配氢氧化钠溶液的浓度偏小,会导致滴定所用氢氧化钠溶液的体积偏大,测量盐酸的浓度偏大,故D不符合.
故选C.
点评:本题考查中和滴定、配制一定物质的量浓度溶液误差分析,难度中等,根据c(HCl)=
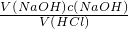 判断所配氢氧化钠溶液的浓度对盐酸浓度测量的影响是关键.
判断所配氢氧化钠溶液的浓度对盐酸浓度测量的影响是关键. 
练习册系列答案
相关题目
下列实验操作过程能引起实验结果偏高的是( )
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管未用标准液润洗
②用量筒量取5.0mL溶液时,俯视读数
③配制一定物质的量浓度的硫酸溶液,定容时仰视容量瓶的刻度线
④质量分数为10%和90%的两种硫酸等体积混合配制50%的硫酸溶液.
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管未用标准液润洗
②用量筒量取5.0mL溶液时,俯视读数
③配制一定物质的量浓度的硫酸溶液,定容时仰视容量瓶的刻度线
④质量分数为10%和90%的两种硫酸等体积混合配制50%的硫酸溶液.
| A、①③ | B、①④ | C、②③ | D、②④ |
下列说法错误的是( )
| A、萃取操作时,选择有机萃取剂,则溶质在萃取剂的溶解度必须比水大 | B、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | C、蒸馏操作时,应使温度计水银球插入混合溶液的液面下 | D、配制一定物质的量浓度的溶液时,洗涤烧杯和玻璃棒的溶液必须转入容量瓶中 |