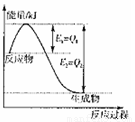
题目内容
向100ml 0.5mol/L AlCl3 中逐渐加入0.5mol/L的NaOH 溶液,最后得到白色沉淀2.34克。求用去的NaOH 溶液的体积。
解:n(AlCl3)=CV=100×10-3L×0.5mol·L-1=0.05mol………………(1分)
沉淀的物质的量n=m/M=0.03mol………………………………………(1分)
① AlCl3 + 3NaOH = Al(OH)3↓+3NaCl
3 1
0.09mol 0.03mol ………………………………(2分)
V(NaOH)=n/c=0.09mol/0.5mol·L-1=180mL……………………………(1分)
② AlCl3 + 3NaOH = Al(OH)3↓+3NaCl
1 3 1
0.05mol 0.15mol 0.05mol ………………………………(2分)
Al(OH)3 + NaOH = Na【Al(OH)4】
1 1
0.02mol 0.02mol ………………………………………………(2分)
V(NaOH)=n/c=(0.15mol+0.02mol)/0.5mol·L-1=340mL………………(1分)

近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)在2升的密闭容器中,充有2mol CO与4mol 水蒸气,在催化剂作用下进行如下化学反应:CO(g)+H2O(g) CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
|
t(℃) |
750 |
850 |
1000 |
|
CO% |
0.7 |
2/3 |
0.5 |
1000℃时该反应的平衡常数为___________________。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时反应___________(填“向右进行”、“向左进行”或“处于平衡状态”)。
(2)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
则CO和H2O生成CO2和H2的热化学方程式为_______________________________。
(3) 目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②若改变条件使平衡向正反应方向移动,则平衡常数______________(填序号)
a.可能不变 b.可能减小 c.可能增大 d.不变、减小、增大皆有可能
(4)NaHCO3的水溶液呈碱性,其原因是(用文字叙述)_______________________。常温下,向100mL
0.2mol/LNaHCO3溶液中滴加amol/L的醋酸溶液,当滴加到溶液呈中性时,所用去的醋酸体积刚好也
为100mL,此时醋酸的电离常数为b, 用含b的代数式表示醋酸的浓度a=_____________________。
 酸、碱、盐都是电解质,在水中都能电离出离子.根据下列化合物:
酸、碱、盐都是电解质,在水中都能电离出离子.根据下列化合物: 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl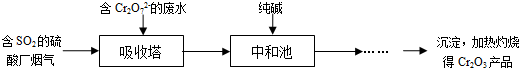

 混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:

 的△H 0(填“>”
的△H 0(填“>”