题目内容
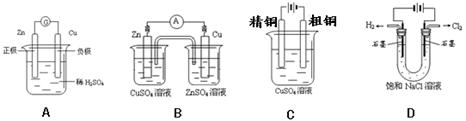
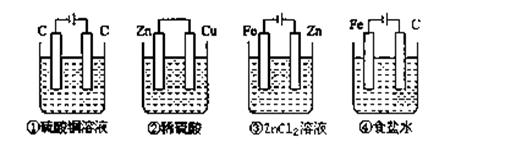
如下图,四种装置中所盛有的溶液体积均为200ml,浓度均为0.6mol/L,工作一段时间后,测得导线上均通过了0.2mol电子,此时溶液中的pH由大到小的顺序是( )

| A.④②①③ | B.④③①② | C.④③②① | D.①③②④ |
C
试题分析:根据装置可知,①是电解硫酸铜溶液的,根据反应式2CuSO4+2H2O
 2Cu+2H2SO4+O2↑可知,溶液中生成0.2mol氢离子;②是原电池,消耗0.2mol氢离子;③是铁上镀锌,溶液的pH不变;④是电解饱和食盐水,根据反应式2Cl-+2H2O
2Cu+2H2SO4+O2↑可知,溶液中生成0.2mol氢离子;②是原电池,消耗0.2mol氢离子;③是铁上镀锌,溶液的pH不变;④是电解饱和食盐水,根据反应式2Cl-+2H2O 2OH-+H2↑+Cl2↑可知,溶液中生成0.2molOH-,所以溶液中的pH由大到小的顺序是④③②①,答案选C。
2OH-+H2↑+Cl2↑可知,溶液中生成0.2molOH-,所以溶液中的pH由大到小的顺序是④③②①,答案选C。点评:本题是电化学原理的综合应用,只要能准确判断出装置是原电池、还是电解池,以及电极反应式等,就不难得出结论。

练习册系列答案
相关题目