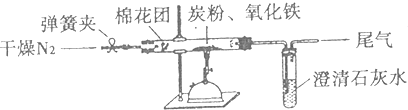
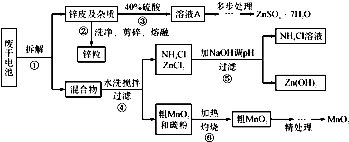
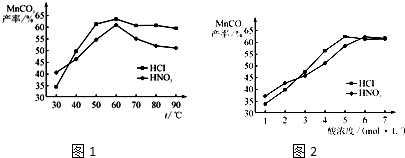
题目内容
对室温下氢离子浓度、体积均相同的HCl溶液和CH3COOH溶液分别采取以下措施,叙述正确的是( )
分析:盐酸是强酸,醋酸是弱酸,醋酸溶液中存在电离平衡,升高温度能促进弱电解质电离,pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,不同的酸和相同金属反应,生成氢气的速率与溶液中离子浓度成正比.
解答:解:A.向盐酸中加入醋酸钠晶体,醋酸钠和盐酸反应生成醋酸,向醋酸中加入醋酸钠,能抑制醋酸电离,所以都导致氢离子浓度都减小,其溶液的pH增大,故A正确;
B.盐酸是强酸,不存在电离平衡,升高温度不影响盐酸的pH,醋酸是弱酸,其水溶液中存在电离平衡,升高温度,促进醋酸电离,导致醋酸溶液中氢离子浓度增大,所以醋酸的pH减小,故B错误;
C.pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,溶液中氢离子浓度都减小,故C错误;
D.pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,且二者都是一元酸,所以分别与足量的锌反应,醋酸产生的氢气比盐酸多,故D错误;
故选A.
B.盐酸是强酸,不存在电离平衡,升高温度不影响盐酸的pH,醋酸是弱酸,其水溶液中存在电离平衡,升高温度,促进醋酸电离,导致醋酸溶液中氢离子浓度增大,所以醋酸的pH减小,故B错误;
C.pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,溶液中氢离子浓度都减小,故C错误;
D.pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,且二者都是一元酸,所以分别与足量的锌反应,醋酸产生的氢气比盐酸多,故D错误;
故选A.
点评:本题考查弱电解质电离,易错选项是B,注意对于相同浓度的盐酸和醋酸溶液,升高温度,盐酸的pH不变,但醋酸的pH改变,为易错点.

练习册系列答案
相关题目