题目内容
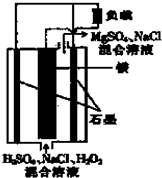
 镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意图如图所示. 关于该电池的叙述正确的是( )
镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意图如图所示. 关于该电池的叙述正确的是( )分析:镁-过氧化氢燃料电池中,Mg为负极,失去电子;石墨为正极,正极上过氧化氢得到电子生成水,阳离子向正极移动,以此来解答.
解答:解:A.高温下,过氧化氢分解,则该电池不可以在高温下正常工作,故A错误;
B.电池工作时,阳离子向正极移动,则H+向正极移动,故B正确;
C.正极上发生H202+2H++2e-=2H20,氢离子减少,则pH增大,故C错误;
D.负极上Mg失去电子,正极上过氧化氢得到电子生成水,则该电池的总反应式为:Mg+H202+H2S04=MgS04+2H20,故D正确;
故选BD.
B.电池工作时,阳离子向正极移动,则H+向正极移动,故B正确;
C.正极上发生H202+2H++2e-=2H20,氢离子减少,则pH增大,故C错误;
D.负极上Mg失去电子,正极上过氧化氢得到电子生成水,则该电池的总反应式为:Mg+H202+H2S04=MgS04+2H20,故D正确;
故选BD.
点评:本题考查原电池,把握原电池的工作原理为解答的关键,注意电极判断和发生的电极反应,题目难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
 镁-过氧化氢燃料电池具有能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4?MgSO4+2H2O.结构示意图如图所示.下列关于该电池的叙述正确的是( )
镁-过氧化氢燃料电池具有能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4?MgSO4+2H2O.结构示意图如图所示.下列关于该电池的叙述正确的是( )| A、电池内部可以使用MnO2作填料 | B、电流工作时,H+向Mg电极移动 | C、电池工作时,正极的电极反应式为Mg-2e-?Mg2+ | D、电池工作时,电解质溶液的pH将不断变大 |
镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意图如图所示.该电池的总反应式为:Mg+H2O2+H2SO4=MgSO4+2H2O关于该电池的叙述正确的是( )
| A、该电池可以在高温下正常工作 | B、电池工作时,H+向正极移动 | C、电池工作时,正极周围溶液的pH将不断变小 | D、正极反应方程式为:H2O2+2H++2e-=2H2O |
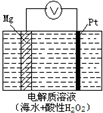 美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁-过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁-过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )