题目内容
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
| A.若A为水,B为Al2S3固体,C中盛硫酸铜溶液,则C中有黑色沉淀生成 |
| B.若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| C.若A为浓氨水,B为碱石灰,C中盛氯化铝溶液,则C中溶液先出现白色浑浊后澄清 |
| D.若A为浓硫酸,B为铜,C中盛石蕊试液,则C中溶液褪色 |
A
解析试题分析:A、Al2S3+6H2O=2Al(OH)3↓+3H2S ↑,H2S +CuSO4=CuS↓+H2SO4.CuS是黑色即不溶解于水也不溶解于酸的物质,所以有黑色沉淀生成。正确。B、贝壳主要成分是碳酸钙。由于醋酸的酸性强于碳酸,所以醋酸和贝壳发生反应产生二氧化碳气体,但是碳酸的酸性比盐酸弱,所以产生二氧化碳气体通入到盛CaCl2溶液,无现象。错误。C、浓氨水加入到碱石灰中产生氨气,再通入到盛氯化铝溶液,时由于一水合氨是弱碱,C中溶液先产生氢氧化铝白色沉淀后不能被过量的氨水溶解。错误。D、浓硫酸和铜发生反应要在加热条件下进行。产生的二氧化硫是酸性气体,能使紫色石蕊试液变红。
考点:考查物质的化学性质的大小及相应的所以现象的知识。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)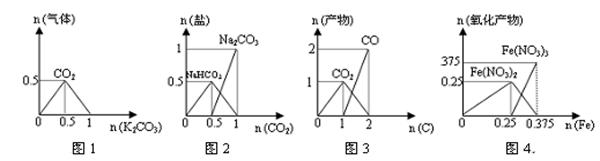
| A.图1:n(HCl)=1mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体 |
| B.图2:n(NaOH)=1mol,CO2逐步通入到NaOH溶液中反应生成的盐 |
| C.图3:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物 |
| D.图4:n(HNO3)=1mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
下列实验或生产操作,其中没有新物质生成的是
①蛋白质溶液中加入硫酸铵后形成沉淀
②碘化银用于人工降雨
③二氧化氮经加压凝成无色液体
④溴水滴入植物油中振荡褪色
⑤水泥、砂子和水混合后硬化
⑥除去混在氢氧化铁胶体中的氯化铁
| A.①②③ | B.②④⑥ | C.③⑤ | D.①⑥ |
下列有关说法正确的是
| A.常温下可用铝制容器存放浓硝酸、浓硫酸、烧碱溶液 |
| B.镁条在空气中燃烧时生成固体产物只有2种 |
| C.合金既属于金属材料,又属于复合材料 |
| D.可用稀硝酸除去银镜反应后试管内壁析出的银 |
下列推断正确的是
| A.SiO2是酸性氧化物,能与NaOH溶液反应 |
| B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 |
| C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液仍呈红色 |
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质丙和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物M,该物质溶于氢氧化钠溶液。化合物乙是工业制取硝酸的原料之一,乙在催化剂存在下可分解得到H2和另一种单质气体丁。下列说法正确的是( )
| A.工业上制备单质丙的方法是电解其氯化物 |
| B.丙丁元素形成化合物可用于制作新型陶瓷 |
| C.甲与水的反应中,水做还原剂 |
| D.单质丙也可以与氢氧化钠反应,并生成白色沉淀物M |
下列化合物,不能通过单质之间反应直接制得的是( )
| A.FeCl3 | B.FeCl2 | C.Na2O2 | D.CuCl2 |
下列各项中,理由、结论及因果关系均正确的是
| 选项 | 理由 | 结论 |
| A | 相同物质的量浓度溶液的pH:BaCl2>MgCl2 | 碱性:Ba(OH)2>Mg(OH)2 |
| B | 相同物质的量的原子失去电子的数目:Al>Na | 还原性:Al>Na |
| C | 相同数目的分子中可电离的H+数:H2SO4>HClO | 酸性:H2SO4>HClO |
| D | 相同物质的量得到电子的数目:稀硝酸>浓硝酸 | 氧化性:稀硝酸>浓硝酸 |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | NH4Cl加热有类似升华现象 | 用加热法除去NaCl中的NH4Cl |
| B | Fe的金属活动性大于Cu | 用FeCl3溶液可以腐蚀Cu |
| C | 水解程度:NaHCO3<Na2CO3 | 溶解度:Na2CO3>NaHCO3 |
| D | HNO3具有不稳定性 | 浓HNO3应保存在棕色试剂瓶中 |