题目内容
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。
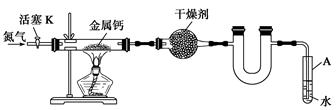
(1)反应过程中末端导管必须始终插入试管A的水中,目的是_____________________。
(2)制备氮化钙的操作步骤是:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,__________________________________________________________;
④拆除装置,取出产物。
(3)数据记录如下:(假设反应完全)
① 计算得到实验式CaxN2,其中x=________。
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
______________________________________________________________________。

(1)反应过程中末端导管必须始终插入试管A的水中,目的是_____________________。
(2)制备氮化钙的操作步骤是:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,__________________________________________________________;
④拆除装置,取出产物。
(3)数据记录如下:(假设反应完全)
| 空硬质管质 量m0/g | 硬质管与钙的 质量m1/g | 硬质管与产物 的质量m2/g |
| 14.80 | 15.08 | 15.15 |
① 计算得到实验式CaxN2,其中x=________。
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
______________________________________________________________________。
(1)防止空气中的氧气通过末端导管进入实验装置,氧化单质钙,生成氧化钙,引入杂质 (1分)
(2)熄灭酒精灯,待玻璃管冷却至室温,停止通入氮气,并关闭活塞 (2分)
(3)①2.80 (1分) ②x<3,产物中生成了CaO导致钙的质量分数减小 (2分)
(2)熄灭酒精灯,待玻璃管冷却至室温,停止通入氮气,并关闭活塞 (2分)
(3)①2.80 (1分) ②x<3,产物中生成了CaO导致钙的质量分数减小 (2分)
试题分析:(1)由于钙非常活泼需防止空气中的氧气通过末端导管进入实验装置通过末端导管进入实验装置,氧化单质钙,生成氧化钙,引入杂质
(2)由实验步骤可知应为熄灭酒精灯,待玻璃管冷却至室温,停止通入氮气,并关闭活塞
(3))m(Ca)=15.08-14.80=0.28g;m(N)=15.15-15.08=0.07g;则
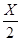 ="("
="("  )/(
)/(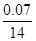 )解得X=2.80
)解得X=2.80①2.80 ②若通入的N2中混有少量O2产物中生成了CaO导致钙的质量分数减小,所以x<3。

练习册系列答案
相关题目

 MnCl2+ Cl2↑+2H2O,在该反应中每生成22.4L(标准状况下)氯气,被氧化HCl的物质的量为__________,转移电子的物质的量为________;d装置中发生反应的离子方程式为_________________。实验室还可以用高锰酸钾和浓盐酸反应制取氯气,完成并配平该反应的离子方程式:
MnCl2+ Cl2↑+2H2O,在该反应中每生成22.4L(标准状况下)氯气,被氧化HCl的物质的量为__________,转移电子的物质的量为________;d装置中发生反应的离子方程式为_________________。实验室还可以用高锰酸钾和浓盐酸反应制取氯气,完成并配平该反应的离子方程式: ____ Mn2+ + ____ Cl2↑+ ____ _________
____ Mn2+ + ____ Cl2↑+ ____ _________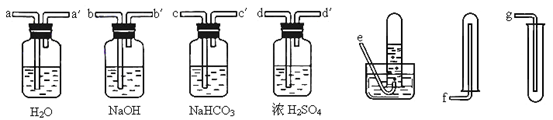

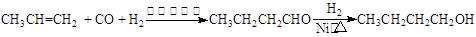
 CO↑+H2O,并设计出原料气的制备装置(如下图)
CO↑+H2O,并设计出原料气的制备装置(如下图)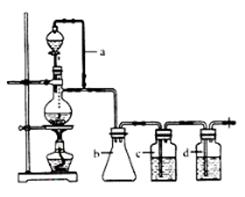
 RCH(OH)SO3Na↓;②沸点:乙醚34℃,
RCH(OH)SO3Na↓;②沸点:乙醚34℃,