题目内容
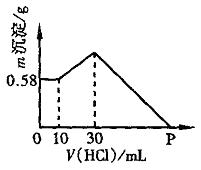
把NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中后,有0.58g白色沉淀。在所得浊液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示。试求:
![]()
![]() (1)混合物中NaOH质量是多少克?
(1)混合物中NaOH质量是多少克?
(2)混合物中AlCl3质量是多少克?
(3)P点所表示的盐酸体积是多少毫升?
(1)2.6g(2)1.335g(3)130mL
解析:
由图可知,NaOH、MgCl2、AlCl3三种固体溶于水时,NaOH过量,0.58g沉淀为Mg(OH)2,10mL盐酸用于中和过量NaOH,30mL-10mL=20mL盐酸和AlO2—反应生成Al(OH)3;最后加入的盐酸溶解Mg(OH)2和Al(OH)3沉淀。
解:(1)由![]()
![]()
![]()
![]()
MgCl2+2NaOH===Mg(OH)2↓+2NaCl
0.02mol ![]()
NaOH + HCl == NaCl + H2O
0.005mol 0.01L×0.5mol/L
AlO2— + H+ + H2O == Al(OH)3↓
0.01mol 0.02L×0.5mol/L 0.01mol
AlCl3 + 4NaOH == NaAlO2 + 3NaCl
0.01mol 0.04mol 0.01mol
由上述可知,n(NaOH)=0.02mol+0.005mol+0.04mol=0.065mol
所以m(NaOH)=0.065mol×40g/mol=2.6g
(2)由(1)可知,n(AlCl3)=0.01mol 所以m(AlCl3)=0.01mol×133.5g/mol=1.335g
(3)由图知:P点溶液的溶质为NaCl、AlCl3、MgCl2,相当于用盐酸中和了原溶液中的NaOH所得的结果,所以n(HCl)=n(NaOH)=0.065mol, ![]()
