题目内容
在标准状况下进行甲、乙、丙三组实验。三组实验均各取30 mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
生成气体/mL | 280 | 336 | 336 |
(1)甲、乙两组实验中,哪一组盐酸是不足量的?______(填“甲”或“乙”)。理由是__________。
(2)盐酸的物质的量浓度为____________。(3)Mg、Al物质的量之比为__________________。
(1)乙 若乙组中的合金完全反应,则产生V(H2)=![]() ×385 mL=423 mL>336 mL,故盐酸不足
×385 mL=423 mL>336 mL,故盐酸不足
(2)1 mol·L-1
(3)1∶1
解析:(1)因甲、乙生成H2的体积不等,则产生H2体积小的,还有酸未反应,说明甲中盐酸过量,合金反应完全;若乙中盐酸过量,则可产生H2:![]() ×385 mL=423 mL,而实际为336 mL,说明乙中盐酸不足,合金过量。
×385 mL=423 mL,而实际为336 mL,说明乙中盐酸不足,合金过量。
(2)在乙或丙中,因盐酸反应完全,则可根据
2HCl ~ H2
2 1
n(HCl) ![]() mol
mol
n(HCl)=3×10-2 mol,c(HCl)=1 mol·L-1
(3)在甲中,因合金反应完全,则可根据:
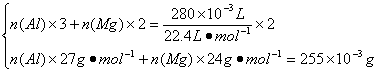
解得:
![]()
![]() 。
。

 阅读快车系列答案
阅读快车系列答案实验序号 | 甲 | 乙 | 丙 |
合金质量/g | 0.255 | 0.385 | 0.459 |
生成气体的体积/mL | 280 | 336 | 336 |
请计算:
(1)盐酸的物质的量浓度。
(2)合金中镁与铝的物质的量的比值。
实验序号 | 甲 | 乙 | 丙 |
合金质量/g | 0.255 | 0.385 | 0.459 |
生成气体的体积/mL | 280 | 336 | 336 |
请计算:
(1)盐酸的物质的量浓度。
(2)合金中镁与铝的物质的量的比值。
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
气体体积/mL | 280 | 336 | 336 |
(1)乙组实验中,盐酸___________________(填“过量”“适量”或“不足量”),理由是_________________________________________________________。
(2)要计算盐酸的物质的量浓度,题中可作为计算依据的数据是_____________________。
(3)要计算合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是__________,Mg、Al的物质的量之比是__________。