题目内容
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中正确的是A.AgCl、AgI两者都不溶于水,因此AgCl与AgI不能相互转化
B.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]() ×10-11 mol·L-1
×10-11 mol·L-1
C.一定条件下AgCl可以转化为更难溶的AgI
D.只能由Ksp较大的不溶物转化为Ksp较小的不溶物
BC 本题考查难溶电解质的溶解平衡。难溶物之间能相互转化,沉淀转化的实质是沉淀溶解平衡的移动。一般来说,溶解度小的沉淀转化成溶解度更小的沉淀容易些。但在一定的条件下,溶解度相对较小的难溶强酸盐(如BaSO4)可以转化为溶解度相对较大的难溶弱酸盐(如BaCO3)。常温下,AgCl若要在NaI溶液中开始转化为AgI,则必须c(Ag+)·c(I-)>Ksp (AgI),即![]() ×10-5·c(I-)>1.0×10-16,所以c(I-)>
×10-5·c(I-)>1.0×10-16,所以c(I-)>![]() ×10-11 mol·L-1。
×10-11 mol·L-1。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l) △H=—97.3kJ/mol
SO2Cl2(l) △H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)。
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
(3)已知某温度下,已知Ksp(AgCl)=2.0×10-10,Ksp(Ag2SO4)=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,当Ag+浓度为0.1mol/L时,浑浊液中Cl-浓度与SO42-浓度之比为 。
⑷将(2)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量是多少(写出计算过程)。

 CH3OH(g)+H2O(g),在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母序号)
CH3OH(g)+H2O(g),在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母序号)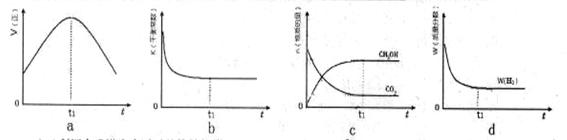
 ×10—11mol•L—1
×10—11mol•L—1 ×10-11
mol·L-1
×10-11
mol·L-1