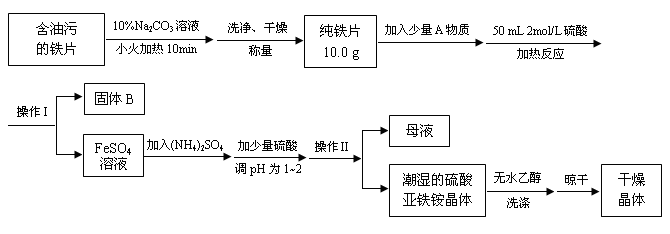
题目内容
(14分)某物质用途广泛,可用作分析试剂、媒染剂、催化剂及化工原料。经测定它含有铁元素,摩尔质量为482g/mol。为进一步确定它的组成,某化学兴趣小组做了以下实验:
Ⅰ.称取48.20g该物质溶于水,配成100mL溶液,所得溶液显棕黄色。
Ⅱ.取上述溶液50mL于试管中,加入足量的0.1mol/LNaOH溶液,并加热,产生的气体经干燥后通入浓硫酸中,浓硫酸增重0.85g;产生的红褐色沉淀经过过滤、洗涤、灼烧后得4.00g固体。
Ⅲ.另取上述溶液50mL于试管中,加入足量的BaCl2溶液,产生不溶于盐酸的白色沉淀 23.30g。
请回答下列问题:
(1)实验Ⅱ中产生气体的电子式 。
(2)该物质的化学式为 ,下列有关该物质的用途合理的是 。
(3)该物质溶液中逐滴加入氢氧化钡溶液至金属元素完全沉淀时的化学反应方程式 。
(4)将SO2气体通入该物质的溶液中可以观察到的实验现象是 ,写出该反应的离子方程式 。
(5)为了进一步验证该物质中铁元素的化合价,某同学设计了如下实验方案:取少量固体于试管中,加水充分溶解,滴加硫氰化钾溶液,若溶液显血红色,即可证明该物质中一定存在Fe3+。请评价该实验操作是否合理 (填“合理”或者“不合理”),理由 。
Ⅰ.称取48.20g该物质溶于水,配成100mL溶液,所得溶液显棕黄色。
Ⅱ.取上述溶液50mL于试管中,加入足量的0.1mol/LNaOH溶液,并加热,产生的气体经干燥后通入浓硫酸中,浓硫酸增重0.85g;产生的红褐色沉淀经过过滤、洗涤、灼烧后得4.00g固体。
Ⅲ.另取上述溶液50mL于试管中,加入足量的BaCl2溶液,产生不溶于盐酸的白色沉淀 23.30g。
请回答下列问题:
(1)实验Ⅱ中产生气体的电子式 。
(2)该物质的化学式为 ,下列有关该物质的用途合理的是 。
| A.补血剂 | B.净水剂 | C.含酚废水的检测试剂 | D.肥料 |
(4)将SO2气体通入该物质的溶液中可以观察到的实验现象是 ,写出该反应的离子方程式 。
(5)为了进一步验证该物质中铁元素的化合价,某同学设计了如下实验方案:取少量固体于试管中,加水充分溶解,滴加硫氰化钾溶液,若溶液显血红色,即可证明该物质中一定存在Fe3+。请评价该实验操作是否合理 (填“合理”或者“不合理”),理由 。
(1)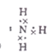
(2)CD;
(3)NH4Fe(SO4)2·12H2O, 2NH4Fe(SO4)2+3Ba(OH)2==2Fe(OH)3↓+3BaSO4↓+ (NH4)2SO4。
(4)溶液由棕黄色变为浅绿色, 2Fe3+ + SO2 + 2H2O ====2Fe2+ + SO42- + 4H+。
(5)不合理,在配制溶液时,蒸馏水应加热煮沸,除去其中溶解的氧气。
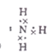
(2)CD;
(3)NH4Fe(SO4)2·12H2O, 2NH4Fe(SO4)2+3Ba(OH)2==2Fe(OH)3↓+3BaSO4↓+ (NH4)2SO4。
(4)溶液由棕黄色变为浅绿色, 2Fe3+ + SO2 + 2H2O ====2Fe2+ + SO42- + 4H+。
(5)不合理,在配制溶液时,蒸馏水应加热煮沸,除去其中溶解的氧气。
试题分析:根据题意知,该物质的摩尔质量为482g/mol,其中含有铁元素。由Ⅰ知,该物质含有Fe3+;由Ⅱ知,向含0.05mol溶质的溶液中加入足量的NaOH溶液,并加热,产生的气体经干燥后通入浓硫酸中,浓硫酸增重0.85g,则产生的氨气为0.05mol;产生的红褐色沉淀氢氧化铁经过过滤、洗涤、灼烧后得4.00g固体,其物质的量为0.025mol,则1mol该物质中含有1molNH4+和1molFe3+。由Ⅲ知,向含0.05mol溶质的溶液中加入足量的BaCl2溶液,产生不溶于盐酸的白色沉淀硫酸钡 23.30g,物质的量为0.1mol,则1mol该物质中含有2molSO42—;则结合该物质的摩尔质量判断,该物质的化学式为NH4Fe(SO4)2·12H2O。(1)实验Ⅱ中产生的气体为氨气,电子式为
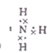 。(2)该物质的化学式为NH4Fe(SO4)2·12H2O,其中含有NH4+和Fe3+,可用作含酚废水的检测试剂和肥料,选CD;(3)该物质的化学式为NH4Fe(SO4)2·12H2O,向该物质溶液中逐滴加入氢氧化钡溶液至铁元素完全沉淀时,生成硫酸钡、氢氧化铁和硫酸铵,化学反应方程式2NH4Fe(SO4)2+3Ba(OH)2==2Fe(OH)3↓+3BaSO4↓+ (NH4)2SO4。(4)将SO2气体通入该物质的溶液中,SO2与Fe3+发生氧化还原反应,Fe3+被还原为Fe2+,观察到的实验现象是溶液由棕黄色变为浅绿色,反应的离子方程式为2Fe3+ + SO2 + 2H2O ====2Fe2+ + SO42- + 4H+。(5)为了进一步验证该物质中铁元素的化合价,某同学设计了如下实验方案:取少量固体于试管中,加水充分溶解,滴加硫氰化钾溶液,若溶液显血红色,即可证明该物质中一定存在Fe3+。该实验操作不合理,理由在配制溶液时,蒸馏水应加热煮沸,除去其中溶解的氧气。
。(2)该物质的化学式为NH4Fe(SO4)2·12H2O,其中含有NH4+和Fe3+,可用作含酚废水的检测试剂和肥料,选CD;(3)该物质的化学式为NH4Fe(SO4)2·12H2O,向该物质溶液中逐滴加入氢氧化钡溶液至铁元素完全沉淀时,生成硫酸钡、氢氧化铁和硫酸铵,化学反应方程式2NH4Fe(SO4)2+3Ba(OH)2==2Fe(OH)3↓+3BaSO4↓+ (NH4)2SO4。(4)将SO2气体通入该物质的溶液中,SO2与Fe3+发生氧化还原反应,Fe3+被还原为Fe2+,观察到的实验现象是溶液由棕黄色变为浅绿色,反应的离子方程式为2Fe3+ + SO2 + 2H2O ====2Fe2+ + SO42- + 4H+。(5)为了进一步验证该物质中铁元素的化合价,某同学设计了如下实验方案:取少量固体于试管中,加水充分溶解,滴加硫氰化钾溶液,若溶液显血红色,即可证明该物质中一定存在Fe3+。该实验操作不合理,理由在配制溶液时,蒸馏水应加热煮沸,除去其中溶解的氧气。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
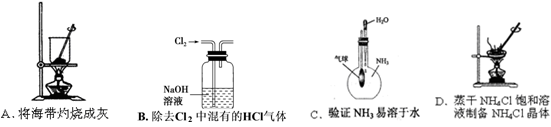
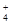 、SO
、SO 离子的实验方法正确的是________(填编号)。
离子的实验方法正确的是________(填编号)。