题目内容
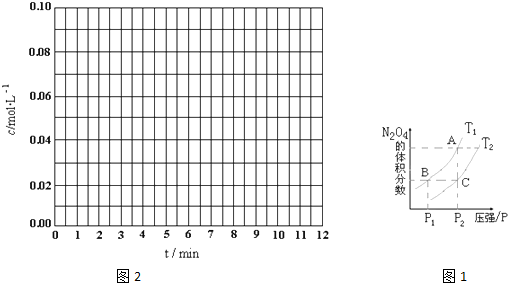
(1)反应2NO2(g)?N2O4(g)△H<0,在温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图1所示.则T1______T2(填“>”、“<”或“=”);增大压强,平衡向______反应方向移动;B、C两点的平衡常数B______C(填“>”或“<”).
(2)反应CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,在800℃时,把等物质的量浓度的CO和H2O(g)充入密闭的反应容器,4min后达到平衡,平衡时c(CO)=0.05mol?L-1,且CO的平衡转化率为50%.请求出该温度下的平衡常数______,并画出H2的物质的量浓度随时间进行的变化图2.
(2)反应CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,在800℃时,把等物质的量浓度的CO和H2O(g)充入密闭的反应容器,4min后达到平衡,平衡时c(CO)=0.05mol?L-1,且CO的平衡转化率为50%.请求出该温度下的平衡常数______,并画出H2的物质的量浓度随时间进行的变化图2.

(1)因为在压强P2时A点的N2O4体积分数高于C点的N2O4体积分数,又反应2NO2(g)?N2O4(g)△H<0为放热反应.所以A点的温度低,
增大压强平衡想体积减小的一方移动,即向正(或右)反应方向移动,
BC两点的温度分别是T1 T2即B点温度低平衡向右移动K值变大即B点K值大,
故答案为:<;正(或右);>;
(2)设CO变化了xmol/L
CO(g)+H2O(g)?H2(g)+CO2(g)
起始浓度(mol/L)(x+0.05)(x+0.05)00
转化浓度(mol/L)xxxx
平衡浓度(mol/L)0.050.05xx
由x/(x+0.05)×100%=50%解得x=0.05mol
平衡后CO(g)、H2O(g)、H2(g)与CO2(g)的浓度均为,则
K=
=1,
H2的物质的量浓度随时间进行的变化图为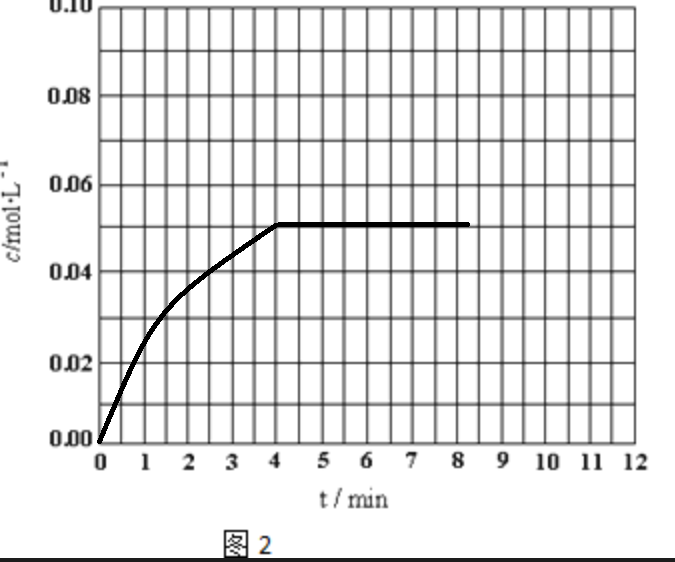 ,
,
故答案为:1; .
.
增大压强平衡想体积减小的一方移动,即向正(或右)反应方向移动,
BC两点的温度分别是T1 T2即B点温度低平衡向右移动K值变大即B点K值大,
故答案为:<;正(或右);>;
(2)设CO变化了xmol/L
CO(g)+H2O(g)?H2(g)+CO2(g)
起始浓度(mol/L)(x+0.05)(x+0.05)00
转化浓度(mol/L)xxxx
平衡浓度(mol/L)0.050.05xx
由x/(x+0.05)×100%=50%解得x=0.05mol
平衡后CO(g)、H2O(g)、H2(g)与CO2(g)的浓度均为,则
K=
| 0.05mol/L×0.05mol/L |
| 0.05mol/L×0.05mol/L |
=1,
H2的物质的量浓度随时间进行的变化图为
 ,
,故答案为:1;
 .
.
练习册系列答案
相关题目
 B(g)+3C(g)在下列四种状态时属于平衡状态的是( )
B(g)+3C(g)在下列四种状态时属于平衡状态的是( )