题目内容
(10分)为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示: ① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
② Na2FeO2+ NaNO2+ H2O → Na2Fe2O4+ NH3↑+ NaOH
③ Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是 。
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是
。
② Na2FeO2+ NaNO2+ H2O → Na2Fe2O4+ NH3↑+ NaOH
③ Na2FeO2+Na2Fe2O4+2H2O
 Fe3O4+4NaOH
Fe3O4+4NaOH(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是 。
| A.该生产过程不会产生污染 | B.反应③生成的四氧化三铁具有抗腐蚀作用 |
| C.反应①②③均是氧化还原反应 | D.反应①②中的氧化剂均为NaNO2 |
。
(10分)
(1)6,1,5,3,1,7 (2分)
(2)Fe 2 (2分)
(3)BD(2分)
(4)反应③可逆,氢氧化钠浓度过大,平衡向逆反应方向移动(2分)
(1)6,1,5,3,1,7 (2分)
(2)Fe 2 (2分)
(3)BD(2分)
(4)反应③可逆,氢氧化钠浓度过大,平衡向逆反应方向移动(2分)
试题分析:该工艺是利用铁离子的氧化产生发蓝,提高枪支的抗腐蚀性。
由题的Fe2+转化为Fe3+,亚铁离子被氧化失去e-,N3+转化为N3-被还原,得6e-,由化学反应电子守恒的,化学方程式为6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH;
(2)还原剂为Fe,Fe从零价到正二价,失去两个电子,所以有1mol Na2FeO2生成,反应中有2mol电子转移;
(3)任何生产过程都会产生一定的污染,A错误;生成四氧化三铁是为了保护枪支抗腐蚀,B正确;反应③并无电子转移和化合价升降,不是氧化还原反应,C错误;反应①②中NaNO2都起氧化作用是氧化剂,D正确
(4)反应③是可逆反应,当氢氧化钠浓度过大时,平衡向逆反应方向移动,减少四氧化三铁的生成,发蓝的厚度变小

练习册系列答案
相关题目

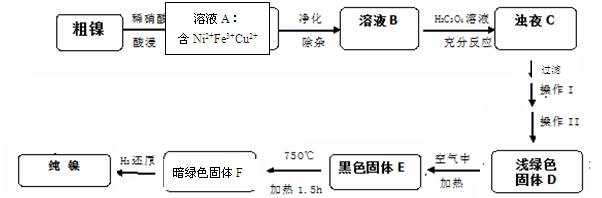
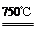 4NiO(暗绿色) + O2↑
4NiO(暗绿色) + O2↑ Si3N4+6CO。下列叙述正确的是
Si3N4+6CO。下列叙述正确的是