题目内容
(13分)某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。请回答:
(1)实验时量取10.00mL氨水样品,配制成100mL待测氨水,则该步操作中需要的仪器有_________________(填仪器名称)。
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_______(填“是”“否”“不能确定”)。
(3)①滴定管盛放盐酸前,要先__________________,用少量蒸馏水洗涤后,再_________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_________________。
②向锥形瓶中滴加0.10mol·L-1的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。
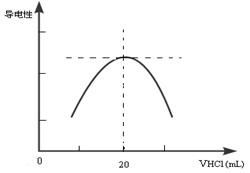
写出氨水与盐酸反应的离子方程式___________________________;该氨水样品的物质的量浓度为_____________。
(4)另一学习小组乙认为上述测量结果仍存在一定误差,因为生成的NH4Cl 是强酸弱碱盐,会发生水解而使NH4+浓度下降,这样,恰好完全反应时NH4+浓度不是最大值,溶液导电性就不是最大值。你认为乙学习小组的结论是否正确?________,理由是___________________。
(1)实验时量取10.00mL氨水样品,配制成100mL待测氨水,则该步操作中需要的仪器有_________________(填仪器名称)。
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_______(填“是”“否”“不能确定”)。
(3)①滴定管盛放盐酸前,要先__________________,用少量蒸馏水洗涤后,再_________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_________________。
②向锥形瓶中滴加0.10mol·L-1的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。

写出氨水与盐酸反应的离子方程式___________________________;该氨水样品的物质的量浓度为_____________。
(4)另一学习小组乙认为上述测量结果仍存在一定误差,因为生成的NH4Cl 是强酸弱碱盐,会发生水解而使NH4+浓度下降,这样,恰好完全反应时NH4+浓度不是最大值,溶液导电性就不是最大值。你认为乙学习小组的结论是否正确?________,理由是___________________。
(共13分)
(1)碱式滴定管、烧杯、玻璃棒、100mL容量瓶、胶头滴管(5分)
(2)否(1分)
(3)①检查滴定管是否漏水(1分),用所要盛放的盐酸润洗2~3次(1分),“0”刻度或“0”刻度以下(1分);
②NH3.H2O +H+=NH4++H2O (1分);1.00mol/L(1分)
(4)不正确(1分),因为NH4+水解后,溶液中离子浓度保持不变(1分)。
(1)碱式滴定管、烧杯、玻璃棒、100mL容量瓶、胶头滴管(5分)
(2)否(1分)
(3)①检查滴定管是否漏水(1分),用所要盛放的盐酸润洗2~3次(1分),“0”刻度或“0”刻度以下(1分);
②NH3.H2O +H+=NH4++H2O (1分);1.00mol/L(1分)
(4)不正确(1分),因为NH4+水解后,溶液中离子浓度保持不变(1分)。
略

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案
相关题目


 色:___________________________________________;
色:___________________________________________;