题目内容
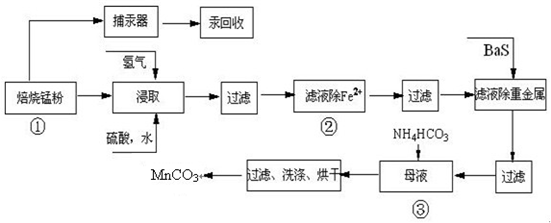
锌锰废电池可回收锌、锰元素生产硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:
试回答下列问题:
(1)硫酸锌水溶液显酸性,用离子方程式说明______.
(2)原料锰粉粗品中主要成分为MnO2和碳,焙烧时反应的化学方程式为MnO2+C=MnO+CO↑,该反应的氧化产物是______.
(3)50-55℃向MnS04的母液中加入足量NH4HC03,反应的化学方程式为:
MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+______+______.
(4)已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6.下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:

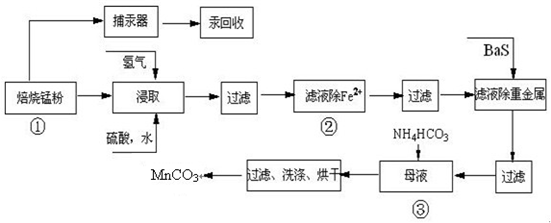
试回答下列问题:
(1)硫酸锌水溶液显酸性,用离子方程式说明______.
(2)原料锰粉粗品中主要成分为MnO2和碳,焙烧时反应的化学方程式为MnO2+C=MnO+CO↑,该反应的氧化产物是______.
(3)50-55℃向MnS04的母液中加入足量NH4HC03,反应的化学方程式为:
MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+______+______.
(4)已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6.下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:
| 实验操作 | 离子方程式 |
| 步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡. | ______ |
| 步骤2:将pH调到______,使Fe3+沉淀完全 | Fe3++3H2O?Fe(OH)3+3H+ |
(1)锌离子水解生成氢氧化锌和氢离子,溶液呈酸性,反应的离子方程式为:Zn2++2H2O?Zn(OH)2+2H+;故答案为:Zn2++2H2O?Zn(OH)2+2H+;
(2)化学方程式为MnO2+C=MnO+CO↑,碳元素化合价从0价变化为+2价,做还原剂被氧化为CO,该反应的氧化产物是CO;
故答案为:CO;
(3)50-55℃向MnS04的母液中加入足量NH4HC03,依据原子守恒得到:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑;
故答案为:H2O,CO2;(4)三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6.过程②是除去亚铁离子的方法,加入氧化剂过氧化氢盐亚铁离子为铁离子,调节溶液PH在3.7~8.6,铁离子完全沉淀,锰离子不沉淀,达到分离杂质的目的;过氧化氢氧化亚铁离子的离子方程式为:2Fe2++H2O+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O+2H+=2Fe3++2H2O;3.7~8.6;
(2)化学方程式为MnO2+C=MnO+CO↑,碳元素化合价从0价变化为+2价,做还原剂被氧化为CO,该反应的氧化产物是CO;
故答案为:CO;
(3)50-55℃向MnS04的母液中加入足量NH4HC03,依据原子守恒得到:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑;
故答案为:H2O,CO2;(4)三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6.过程②是除去亚铁离子的方法,加入氧化剂过氧化氢盐亚铁离子为铁离子,调节溶液PH在3.7~8.6,铁离子完全沉淀,锰离子不沉淀,达到分离杂质的目的;过氧化氢氧化亚铁离子的离子方程式为:2Fe2++H2O+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O+2H+=2Fe3++2H2O;3.7~8.6;

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
锌锰废电池可回收锌、锰元素生产硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:
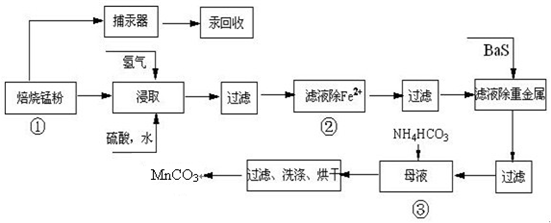
试回答下列问题:
(1)硫酸锌水溶液显酸性,用离子方程式说明______.
(2)原料锰粉粗品中主要成分为MnO2和碳,焙烧时反应的化学方程式为MnO2+C=MnO+CO↑,该反应的氧化产物是______.
(3)50-55℃向MnS04的母液中加入足量NH4HC03,反应的化学方程式为:
MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+______+______.
(4)已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6.下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:
| 实验操作 | 离子方程式 |
| 步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡. | ______ |
| 步骤2:将pH调到______,使Fe3+沉淀完全 | Fe3++3H2O?Fe(OH)3+3H+ |
锌锰废电池可回收锌、锰元素生产硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:
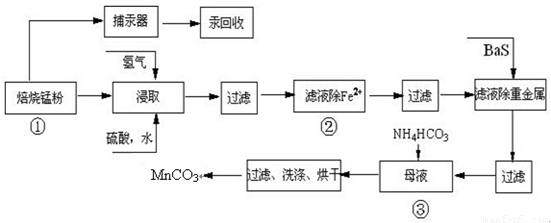
试回答下列问题:
(1)硫酸锌水溶液显酸性,用离子方程式说明______.
(2)原料锰粉粗品中主要成分为MnO2和碳,焙烧时反应的化学方程式为MnO2+C=MnO+CO↑,该反应的氧化产物是______.
(3)50-55℃向MnS04的母液中加入足量NH4HC03,反应的化学方程式为:
MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+______+______.
(4)已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6.下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:

试回答下列问题:
(1)硫酸锌水溶液显酸性,用离子方程式说明______.
(2)原料锰粉粗品中主要成分为MnO2和碳,焙烧时反应的化学方程式为MnO2+C=MnO+CO↑,该反应的氧化产物是______.
(3)50-55℃向MnS04的母液中加入足量NH4HC03,反应的化学方程式为:
MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+______+______.
(4)已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6.下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:
| 实验操作 | 离子方程式 |
| 步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡. | ______ |
| 步骤2:将pH调到______,使Fe3+沉淀完全 | Fe3++3H2O?Fe(OH)3+3H+ |