题目内容
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是:
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是:
| A.放电时正极反应为:FeO42-+4H2O+3e-=Fe(OH)3+5OH- |
| B.充电时阴极反应为:Zn(OH)2+2e-=Zn+2OH- |
| C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D.充电时阳极附近溶液的pH减小 |
C
解析试题分析:根据电池总反应3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH可知,放电时为原电池,Zn被氧化,作原电池的负极,电极反应式为3Zn-6e-+6OH-═3Zn(OH)2,K2FeO4被还原,作原电池的正极,电极反应式为2FeO42-+6e-+8H2O═2Fe(OH)3+10OH-,充电时为电解池,阴极发生还原反应,电极反应式为:3Zn(OH)2+6e-=3Zn+6OH-,阳极发生氧化反应,电极反应式为:2Fe(OH)3+10OH--6e-=2FeO42-+6e-+8H2O,结合电极反应式解答该题;A、放电时,K2FeO4为电池的正极,发生还原反应,生成Fe(OH)3,电极反应式为2FeO42-+6e-+8H2O═2Fe(OH)3+10OH-,正确; B、充电时阴极反应为:Zn(OH)2+2e-=Zn+2OH-,正确;C、放电时,Fe化合价由+6价降低为+3价,则放电时每转移3mol电子,正极有1molK2FeO4被还原,错误;D、由充电时阳极反应式知,充电时阳极附近溶液的pH减小,正确。
3Zn(OH)2+2Fe(OH)3+4KOH可知,放电时为原电池,Zn被氧化,作原电池的负极,电极反应式为3Zn-6e-+6OH-═3Zn(OH)2,K2FeO4被还原,作原电池的正极,电极反应式为2FeO42-+6e-+8H2O═2Fe(OH)3+10OH-,充电时为电解池,阴极发生还原反应,电极反应式为:3Zn(OH)2+6e-=3Zn+6OH-,阳极发生氧化反应,电极反应式为:2Fe(OH)3+10OH--6e-=2FeO42-+6e-+8H2O,结合电极反应式解答该题;A、放电时,K2FeO4为电池的正极,发生还原反应,生成Fe(OH)3,电极反应式为2FeO42-+6e-+8H2O═2Fe(OH)3+10OH-,正确; B、充电时阴极反应为:Zn(OH)2+2e-=Zn+2OH-,正确;C、放电时,Fe化合价由+6价降低为+3价,则放电时每转移3mol电子,正极有1molK2FeO4被还原,错误;D、由充电时阳极反应式知,充电时阳极附近溶液的pH减小,正确。
考点:考查化学电源、原电池和电解池的原理。

Li-SOCl2电池可用于心脏起搏器。电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl +S +SO2。电池工作时,下列说法不正确的是 ( )
| A.锂电极发生氧化反应 |
| B.电子从锂电极通过外电路流向碳电极 |
| C.每生成1mol SO2转移4mol电子 |
| D.SOCl2既是氧化剂又是还原剂 |
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
用如图装置实验,下列叙述不正确的是( )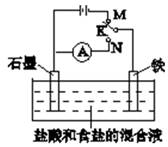
| A.K与N连接时,组成原电池装置 |
| B.K与N连接时,石墨电极产生气泡 |
| C.K与M连接时,一段时间后溶液的pH增小 |
| D.K与M连接时,石墨电极的反应为:2Cl--2e-=Cl2↑ |
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )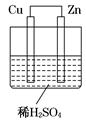
| 卡片号:2 2013.3.15,实验后的记录: ①Cu为负极,Zn为正极 ②Cu极上有气泡产生 ③SO42– 向Cu极移动 ④ 若有0.5mol电子流经导线,则可产生0.25mol气体 ⑤ 电子的流向是:Cu→Zn ⑥正极反应式:Cu +2e- = Cu2+ |
下列关于金属腐蚀与防护的说法不正确的是
| A.金属腐蚀就是金属失去电子被氧化的过程。 |
| B.铝制品的耐腐蚀性强,说明铝的化学性质不活泼 |
| C.将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀 |
| D.铁在NaOH和NaNO2的混合液中发蓝、发黑,使铁表面生成一层致密的氧化膜Fe3O4,防止钢铁腐蚀,其反应为:9Fe+8H2O+4NaNO2=3Fe3O4+4NH3↑+4NaOH |
理论上不能设计为原电池的化学反应是( )
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(1);△H<0 |
| B.HNO3(1)+NaOH(1)=NaNO3(1)+H2O(1);△H<0 |
| C.2H2(g)+O2(g)=2H2O(1);△H<0 |
| D.2FeCl3(1)+Fe(s)=3FeCl2(1);△H<0 |
实验发现,在FeCl3酸性溶液中加入少量锌粉后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是( )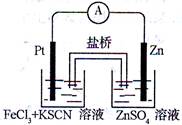
| A.该原电池的正极反应是:Zn-2e— =Zn2+ |
| B.Pt电极表面生成大量气泡 |
| C.左烧杯中溶液的红色逐渐褪去 |
| D.生成的Fe2+通过盐桥可以和锌直接反应生成Fe |
 从右向左移动。下列分析正确的是
从右向左移动。下列分析正确的是
