题目内容
 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解.该反应的化学方程式为:______.
(2)在一定体积的10mol?L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积______(填“大于”、“等于”或“小于”)180mL.若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为______.
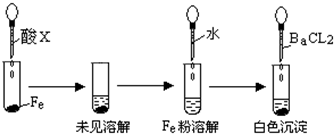
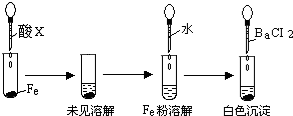
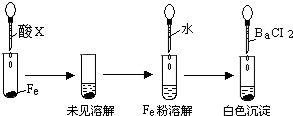
(3)根据下图操作及现象推断酸X为______(填序号).
a、浓盐酸 b、浓硫酸 c、浓硝酸.
解:(1)双氧水具有氧化性,在酸性环境下能将金属铜氧化,方程式为:Cu+H2O2+2HCl=CuCl2+2H2O,用电解原理实现铜和盐酸的反应,根据电解原理阳极必须是金属铜,电解质必须是稀盐酸,故答案为:Cu+H2O2+2HCl=CuCl2+2H2O;
(2)铜只能和浓硫酸反应和稀硫酸不反应,Cu+2H2SO4(浓) CuSO4+SO2↑+H2O,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则18mol?L-1的浓硫酸的实际体积要大于180mL;若使剩余的铜片继续溶解,可向其中加入硝酸盐,应为溶液中有H+,再加入硝酸盐引入NO3-,相当于存在了硝酸,硝酸能将同溶解,反应实质为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:大于;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
CuSO4+SO2↑+H2O,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则18mol?L-1的浓硫酸的实际体积要大于180mL;若使剩余的铜片继续溶解,可向其中加入硝酸盐,应为溶液中有H+,再加入硝酸盐引入NO3-,相当于存在了硝酸,硝酸能将同溶解,反应实质为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:大于;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)因浓硫酸能使金属铁发生钝化,而稀硫酸能与铁发生反应,所以根据现象,可推断酸X为浓硫酸,故选:b.
分析:(1)双氧水具有氧化性,在酸性环境下能将金属铜氧化;
(2)铜只能和浓硫酸反应和稀硫酸不反应,铜可以被硝酸氧化;
(3)根据浓硫酸能使金属铁发生钝化;而稀硫酸能与铁发生反应;
点评:本题考查了金属铜和酸反应的化学性质,题目综合性较强,难度较大.
(2)铜只能和浓硫酸反应和稀硫酸不反应,Cu+2H2SO4(浓)
 CuSO4+SO2↑+H2O,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则18mol?L-1的浓硫酸的实际体积要大于180mL;若使剩余的铜片继续溶解,可向其中加入硝酸盐,应为溶液中有H+,再加入硝酸盐引入NO3-,相当于存在了硝酸,硝酸能将同溶解,反应实质为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:大于;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
CuSO4+SO2↑+H2O,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则18mol?L-1的浓硫酸的实际体积要大于180mL;若使剩余的铜片继续溶解,可向其中加入硝酸盐,应为溶液中有H+,再加入硝酸盐引入NO3-,相当于存在了硝酸,硝酸能将同溶解,反应实质为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:大于;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;(3)因浓硫酸能使金属铁发生钝化,而稀硫酸能与铁发生反应,所以根据现象,可推断酸X为浓硫酸,故选:b.
分析:(1)双氧水具有氧化性,在酸性环境下能将金属铜氧化;
(2)铜只能和浓硫酸反应和稀硫酸不反应,铜可以被硝酸氧化;
(3)根据浓硫酸能使金属铁发生钝化;而稀硫酸能与铁发生反应;
点评:本题考查了金属铜和酸反应的化学性质,题目综合性较强,难度较大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题: