题目内容
对于可逆反应N2(g)+3H2(g) 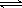 2NH3(g) ΔH<0,下列研究目的和示意图相符的是
2NH3(g) ΔH<0,下列研究目的和示意图相符的是
A B C D
研究目的 压强对反应的影响(p2>p1) 温度对反应的影响 平衡体系中增加N2的浓度对反应的影响 催化剂对反应的影响
示意图 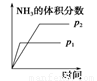
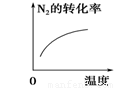
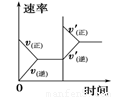
【答案】
C
【解析】
试题分析:A.增大压强,化学反应速率加快,达到平衡所需要的时间更少。P1>P2。错误。B.升高温度,化学平衡向吸热反应方向即向逆反应方向移动。N2的转化率降低。错误。C.平衡体系中增加N2的浓度。在这一瞬间,反应物的浓度突然增大,生成物的浓度不变,所以V(正)>V(逆).所以化学平衡向正反应方向移动,直至达到新的平衡。正确。D.加入催化剂,由于改变了反应途径,化学反应速率大大加快,缩短了达到平衡所需要的时间。错误。
考点:考查浓度、温度、压强、催化剂等外界条件对化学反应速率和化学平衡的影响的知识。

练习册系列答案
相关题目
对于可逆反应N2(g)+3H2(g)![]() 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
|
|
|
对于可逆反应N2(g)+3H2(g) 2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
| A.v(H2)=0.005 mol/(L·s) | B.v(NH3)=0.01 mol/(L·s) |
| C.v(N2)=0.2 mol/(L·min) | D.v(H2)=0.4 mol/(L·min) |




 2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是