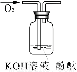题目内容
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.100mL 0.1mol·L—1的稀硫酸中含有H+个数为0.2NA
B.每有1molFe参与氧化还原反应失去电子数目均为2NA
C.金属钠和氧气反应制取过氧化钠,每生成1mol过氧化钠,转移电子数为4NA
D.Zn和稀硫酸反应,每生成1mol氢气转移电子数为2NA
【解析】
试题分析:A、100mL 0.1mol·L—1的稀硫酸中含有H+个数为0.02NA ;B、每有1molFe参与氧化还原反应
失去电子数目为2NA 或3 NA ;C、金属钠和氧气反应制取过氧化钠,每生成1mol过氧化钠,转移电
子数为2NA,D、Zn和稀硫酸反应,每生成1mol氢气转移电子数为2NA。
考点:物质的量的相关计算,氧化还原反应。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
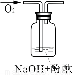
小学生10分钟应用题系列答案实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因。
[分析与猜想]
(1)根据过氧化钠与水反应的原理:2Na2O2 + 2H2O = 4NaOH + O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会退色,而实验中发现酚酞变红后又退色。由此提出如下的猜想:
A.氧气有漂白性
B.氢氧化钠有漂白性
C.
[实验与判断] 请完成下列表格:
实验编号 | 1 | 2 | 3 |
实验装置 | | | |
验证猜想 |
| C |
|
实验现象 | 溶液变红后不退色 | ||
实验说明 | 1、2的实验中NaOH溶液是用 (填“氢氧化钠固体”、“氧化钠固体”、“过氧化钠固体”)溶于水配制的。 | ||
(2)根据以上实验分析发现:过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不很稳定、具有漂白性的物质X,X的化学式是 。
(3)可用右图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是 (填选项,下同),②处装入的物质是 。
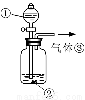
A.酚酞试剂 B.过氧化钠与水反应后的溶液
C.二氧化锰 D.氢氧化钠固体配制的溶液
(4)气体③是 ,过氧化钠与水反应的化学方程式没有写出X来,原因是 。
下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。請根据此表,结合学过的化学知识,回答下列问题:
配料表 | 精制海盐、碘酸钾(KIO3) |
含碘量 | 20―40mg/kg |
储藏方法 | 密封避光、防潮 |
食用方法 | 烹调时待食品熟后加入碘盐 |
据物质分类中的树状分类法有关知识,在①HIO3;②碘酸钠;③KOH;④I2O5;⑤NaCl五种均属于 (填“混合物”或“化合物”或“盐”或“氧化物”),其中与碘酸钾(KIO3)属于同类物质的有 (填序号)。
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾(KIO3) 溶于水(填“能”或“不能”),化学性质:碘酸钾(KIO3)在受热时 。