题目内容
(4分)配平下列反应方程式并标出双线桥
KClO3+ KCl+ H2SO4 — Cl2↑+ K2SO4+ H2O
【答案】
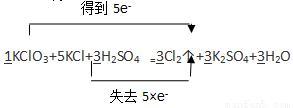
【解析】由反应前后的元素化合价变化可知KClO3作氧化剂(氯元素的化合价由+5价降低到0价),KCl作还原剂(氯元素的化合价-1价升高到0价),即氯气既是氧化产物又是还原产物,由电子的得失守衡可知氧化剂和还原剂的物质的量之比是1︰5。因此KClO3和KCl的计量数分别为1和5,然后通过观察法配平其它物质的计量数。

练习册系列答案
相关题目
碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛.完成下列填空.
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜.请完成并配平下述反应:
KI+ CuSO4→ I2+ Cu2I2↓+
该反应中氧化剂与还原剂的物质的量之比为 .
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去.写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是 .
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2+Hg→Cu2HgI4(玫瑰红)+2Cu
产物Cu2HgI4中,Cu元素显 价.当有1molCu2I2参与反应时,转移电子 mol.
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再入适量的Cl2后进行N操作.试剂M和操作N的组合正确的是 (选填编号)
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜.请完成并配平下述反应:
该反应中氧化剂与还原剂的物质的量之比为
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去.写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2+Hg→Cu2HgI4(玫瑰红)+2Cu
产物Cu2HgI4中,Cu元素显
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再入适量的Cl2后进行N操作.试剂M和操作N的组合正确的是
| 选项 | 试剂M | 操作N |
| a | 碘化钾溶液 | 升华 |
| b | 氢碘酸溶液 | 萃取分液 |
| c | 氢气 | 过滤 |
| d | 氢硫酸溶液B2 51 P9 |
过滤 |