题目内容
(7分)下图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质。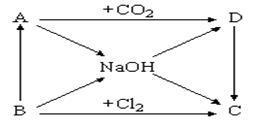
(1)写出C的化学式:________________ 。
(2)写出实现下列变化的化学方程式:
① B → NaOH:________________________________________,
② A → D:________________________________________ ,
(3)浓NaOH溶液能跟地壳中含量最多的金属元素的单质反应,写出该反应的离子方程式:____________________ 。
(方程式每个2分,共7分)(1)NaCl(1分)
(2)① 2Na+2H2O===2NaOH+H2↑ ;②2Na2O2+2CO2===2Na2CO3+O2
(3)2Al+2OH—+2H2O=2AlO2—+3H2↑
解析

练习册系列答案
相关题目
 CH3OH(g)。
CH3OH(g)。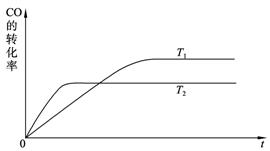
 的催化剂d. 充入He,使体系总压强增大
的催化剂d. 充入He,使体系总压强增大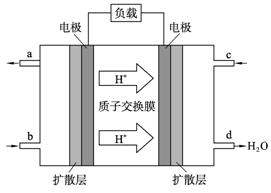
 CH3OH(g)。
CH3OH(g)。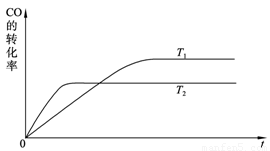
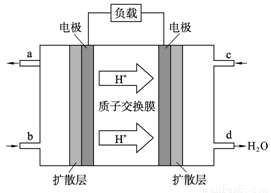
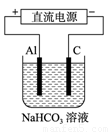
 CH3OH(g)。
CH3OH(g)。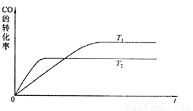
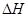 0(填“>”、“<”或“=”)。
0(填“>”、“<”或“=”)。