题目内容
S、N、Cl都是重要的非金属元素,下列说法正确是
- A.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49%
- B.SO32-、ClO-、NO3-三种离子在溶液中因发生氧化还原反应而不能大量共存
- C.浓硫酸、硝酸具有强氧化性,浓硝酸和浓盐酸易分解具有不稳定性
- D.标况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA个(NA为阿伏加德罗常数)
B
分析:A.水的密度小于浓硫酸的密度,等体积混合后溶液的质量小于浓硫酸质量的2倍;
B.ClO-具有强氧化性,可以氧化SO32-,不能大量共存;
C.浓盐酸易挥发,HCl不易分解;
D.根据n=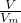 计算氯气的物质的量,发生反应Cl2+2NaOH=NaCl+NaClO+H2O,反应中氯气起氧化剂、还原剂作用,各占一半,结合化合价计算电子转移数目.
计算氯气的物质的量,发生反应Cl2+2NaOH=NaCl+NaClO+H2O,反应中氯气起氧化剂、还原剂作用,各占一半,结合化合价计算电子转移数目.
解答:A.混合后溶液中溶质硫酸的质量等于原浓硫酸中溶质硫酸的质量,水的密度小于浓硫酸的密度,等体积混合后溶液的质量小于浓硫酸质量的2倍,故混合后硫酸的质量分数大于49%,故A错误;
B.ClO-具有强氧化性,可以氧化SO32-,发生氧化还原反应而不能大量共存,故B正确;
C.浓硫酸、硝酸具有强氧化性,浓硝酸易分解具有不稳定性,但浓盐酸易挥发,HCl不易分解,稳定性强,故C错误;
D.标况下,22.4L氯气的物质的量为1mol,发生反应Cl2+2NaOH=NaCl+NaClO+H2O,反应中氯气起氧化剂、还原剂作用,各占一半,故电子转移数目为1mol× ×2×NAmol-1=NA,故D错误;
×2×NAmol-1=NA,故D错误;
故选B.
点评:本题考查质量分数计算、离子共存、常用化学计量计算、物质性质等,难度中等,注意B选项中硝酸根在酸性条件下具有强氧化性,中性、碱性条件没有氧化性,次氯酸根、高锰酸根酸性碱性都有强氧化性,酸性越强氧化性越强.
分析:A.水的密度小于浓硫酸的密度,等体积混合后溶液的质量小于浓硫酸质量的2倍;
B.ClO-具有强氧化性,可以氧化SO32-,不能大量共存;
C.浓盐酸易挥发,HCl不易分解;
D.根据n=
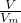 计算氯气的物质的量,发生反应Cl2+2NaOH=NaCl+NaClO+H2O,反应中氯气起氧化剂、还原剂作用,各占一半,结合化合价计算电子转移数目.
计算氯气的物质的量,发生反应Cl2+2NaOH=NaCl+NaClO+H2O,反应中氯气起氧化剂、还原剂作用,各占一半,结合化合价计算电子转移数目.解答:A.混合后溶液中溶质硫酸的质量等于原浓硫酸中溶质硫酸的质量,水的密度小于浓硫酸的密度,等体积混合后溶液的质量小于浓硫酸质量的2倍,故混合后硫酸的质量分数大于49%,故A错误;
B.ClO-具有强氧化性,可以氧化SO32-,发生氧化还原反应而不能大量共存,故B正确;
C.浓硫酸、硝酸具有强氧化性,浓硝酸易分解具有不稳定性,但浓盐酸易挥发,HCl不易分解,稳定性强,故C错误;
D.标况下,22.4L氯气的物质的量为1mol,发生反应Cl2+2NaOH=NaCl+NaClO+H2O,反应中氯气起氧化剂、还原剂作用,各占一半,故电子转移数目为1mol×
 ×2×NAmol-1=NA,故D错误;
×2×NAmol-1=NA,故D错误;故选B.
点评:本题考查质量分数计算、离子共存、常用化学计量计算、物质性质等,难度中等,注意B选项中硝酸根在酸性条件下具有强氧化性,中性、碱性条件没有氧化性,次氯酸根、高锰酸根酸性碱性都有强氧化性,酸性越强氧化性越强.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
S、N、Cl都是重要的非金属元素,下列说法正确是( )
| A、98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49% | B、SO32-、ClO-、NO3-三种离子在溶液中因发生氧化还原反应而不能大量共存 | C、浓硫酸、硝酸具有强氧化性,浓硝酸和浓盐酸易分解具有不稳定性 | D、标况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA个(NA为阿伏加德罗常数) |
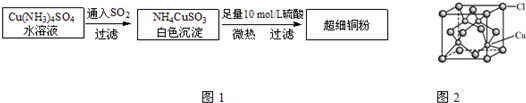
 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.