题目内容
有资料报道:铁酸钠(Na2FeO4)是一种强氧化剂,可作为一种新型净水剂,在反应中Fe6+被还原为Fe3+,使用该物质可代替Cl2和Al2(SO4)3。(1)用废铁屑制Fe2O3。向有铁锈的废铁屑中加入稀硫酸,至铁屑全部溶解。再通过一系列化学过程得到Fe2O3。写出向有铁锈的废铁屑中加入稀硫酸过程中发生反应的离子方程式:________________。
(2)制备铁酸钠。氧化铁在碱性溶液中与硝酸钠反应制得铁酸钠。
Fe2O3+NaNO3+NaOH→Na2FeO4+NaNO2+H2O(未配平)
当反应物中含有1.4molNa+,上述反应恰好完全进行时,电子转移总数为_______NA。
(3)制备铁酸钠剩余的废液中含有NaNO2,直接排放会造成污染,下列试剂中①NaCl、②NH4Cl、③KMnO4、④浓硫酸,能使NaNO2转化为N2(不引起二次污染)的是______________(填编号),反应的离子方程式为____________________________________。
(1)Fe+2H+=Fe2++H2↑、 Fe2O3+6H+=2Fe3++3H2O、 2Fe3++Fe=3Fe2+
(2)1.2
(3)②; 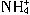 +N
+N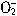 =N2↑+2H2O
=N2↑+2H2O


(2)当反应物中含有1.4mol钠离子,上述反应恰好完全进行时,电子转移总数为____NA。
(3)Na2FeO4代替Cl2是因为它具有__________性,还原为Fe3+后净水的原理为(用离子方程式表示)_________
(4)某厂制备铁酸钠后的废液中含NaNO2溶液,直接排放会造成污染,下列试剂中
①NaCl ②NH4Cl ③KMnO4 ④浓H2SO4,能使NaNO2转化为N2(不引起二次污染的)是______(选填编号),反应离子方程式___________________________