��Ŀ����
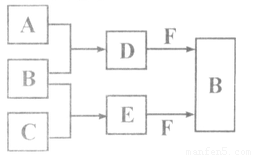
��12�֣�A��B��C�����ֳ���������Ԫ�صĵ��ʡ�������DΪ��ɫҺ�壬E��һ�ֳ������������塣��ת����ϵ��ͼ����Ӧ�����Ͳ��ֲ�����ȥ�����Իش�
��1��E�Ľṹʽ�� ��
��2������X��B��D��һ�������¾��ܷ�Ӧ���ɺ�ɫ���Թ���Y��X��D����Y�Ļ�ѧ����ʽ�� ��
��3������Z��B��Ϊͬ�������壬�������ڶԿ�������ɱ����������ˮ�����ʵȡ�Z�����Ե⻯����Һ��Ӧ����B�͵ⵥ�ʣ���Ӧ�����ӷ���ʽ�� ��
��4��E��H2�����ںϳ�CH3OH��H2O��ÿ4��4gE���뷴Ӧ����13��09kJ����25�棬101 kPaʱ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��5��ȡ0��3 mol F������D��ֻ�Ϻ���ͨ��0��4 mol Eǡ����ȫ�����գ�������Һ�и������ӵ�Ũ���ɴ�С��˳���� ��
��1��O=C=O��2�֣�
��2��3 Fe+4H2O��g�� Fe3O4+4H2��2�֣�д��Ҳ�ɷ֣�
Fe3O4+4H2��2�֣�д��Ҳ�ɷ֣�
��3��O3+2H++2I+=O2+I2+H2O��2�֣�
��4��CO2��g��+3H2��g��=CH3OH��1����H=-130��9kJ��mol��3�֣���һ���Ӳ��۷֣�
��5��c��Na+��>c��HCO3-��>c��CO32-��>c��OH+��>c��H+�� ��3�֣�
��������

 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д� ����������������ϵ�д�
����������������ϵ�д�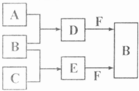 A��B��C�����ֳ���������Ԫ�صĵ��ʣ�������DΪ��ɫҺ�壬E��һ�ֳ������������壮��ת����ϵ��ͼ����Ӧ�����Ͳ��ֲ�����ȥ�����Իش�
A��B��C�����ֳ���������Ԫ�صĵ��ʣ�������DΪ��ɫҺ�壬E��һ�ֳ������������壮��ת����ϵ��ͼ����Ӧ�����Ͳ��ֲ�����ȥ�����Իش�

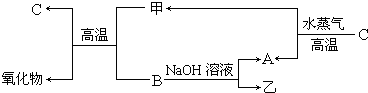
 �ס��ҡ������ֳ������ʣ�A��B��C�����ֳ����Ļ����AΪ����ɫ���壻����֮���ת����ϵ��ͼ��ʾ������д���пհף�
�ס��ҡ������ֳ������ʣ�A��B��C�����ֳ����Ļ����AΪ����ɫ���壻����֮���ת����ϵ��ͼ��ʾ������д���пհף�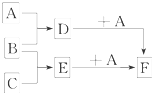 ��֪A��B��C�����ֳ����ĵ��ʣ�����AΪ���壬B��CΪ���壻D�ı�����Һ�����ˮ�м�����У���Һ�ʺ��ɫ��B��C��Ӧʱ�ɹ۲쵽��ɫ���棬����K������ˮ����ɫ��ҺE������֮��ת����ϵ��ͼ��ʾ��
��֪A��B��C�����ֳ����ĵ��ʣ�����AΪ���壬B��CΪ���壻D�ı�����Һ�����ˮ�м�����У���Һ�ʺ��ɫ��B��C��Ӧʱ�ɹ۲쵽��ɫ���棬����K������ˮ����ɫ��ҺE������֮��ת����ϵ��ͼ��ʾ��