题目内容
甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)![]() HCOOH(l)+CH3OH(l) ΔH>0
HCOOH(l)+CH3OH(l) ΔH>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化见下图:

(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
平均反应速率/(10-3 mol·min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
请计算15~20 min范围内甲酸甲酯的减少量为_____________________mol,甲酸甲酯的平均反应速率为__________________________mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:_______________________________________________________________________________。
(3)上述反应的平衡常数表达式为:![]() ,则该反应在温度T1下的K值为___________________________________。
,则该反应在温度T1下的K值为___________________________________。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
(1)0.045 9×10-3
(2)该反应中甲酸具有催化作用
①反应初期:虽然甲酸甲酯量较大,但甲酸量很小,催化效果不明显,反应速率较慢;
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大;
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零
(3)0.14
(4)

解析:(1)由15 min、20 min时的转化率即可求甲酸甲酯在15~20 min的减少量及反应速率。
(3)由图象知,平衡状态下HCOOCH3的转化率为24%。
HCOOCH3+H2O![]() HCOOH+CH3OH
HCOOH+CH3OH
n0 1.00 mol 1.99 mol0.01 mol 0.52 mol
n平 0.76 mol 1.75 mol0.25 mol 0.76 mol
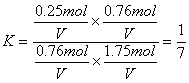

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案 (2013?保定一模)甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l)?HCOOCH(aq)+CH3OH(aq)△H>0.某温度下,VL溶液中各组分的起始量如表:HCOOCH3转化率随反 应时间(t)的变化如图(假设溶液体积不变)下列说法正确的是( )
(2013?保定一模)甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l)?HCOOCH(aq)+CH3OH(aq)△H>0.某温度下,VL溶液中各组分的起始量如表:HCOOCH3转化率随反 应时间(t)的变化如图(假设溶液体积不变)下列说法正确的是( ) HCOOH(aq)+CH3OH(aq)
△H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是
HCOOH(aq)+CH3OH(aq)
△H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是