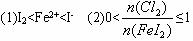题目内容
向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子的物质的量随n(Cl2):n(FeI2)的变化可用如图简单表示,下列有关说法中正确的是( )
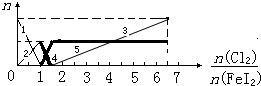

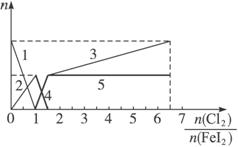
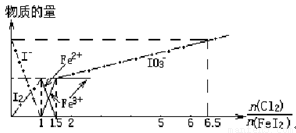
| A、粗线5、细线3分别代表n(Fe3+)、n(IO3-)随n(Cl2):n(FeI2)变化的情况 | B、假设通入Cl2的过程中溶液的体积不变,则溶液的pH始终不变 | C、当n(Cl2):n(FeI2)=6.5时,溶液中n(Cl-):n(IO3-)=13 | D、当n(Cl2):n(FeI2)=1.2时,离子方程式可表示为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl- |
分析:由还原性强弱顺序为:I->Fe2+>I2,则在不断通Cl2的过程中,依次发生以下氧化还原反应:Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、5Cl2+I2+6H2O=2IO3-+12H++10Cl-.可见,当n(Cl2):n(FeI2)=1:1时,I-恰好全被氧化;当n(Cl2):n(FeI2)=1.5时,Fe2+正好全被氧化;当n(Cl2):n(FeI2)=6.5时,氧化还原反应完毕.
因此,当n(Cl2):n(FeI2)>1:1时,开始生成Fe3+至1.5时,Fe3+达到最大量,故粗线5代表了n(Fe3+)的变化;
当n(Cl2):n(FeI2)>1.5时,开始生成IO3-,至6.5时,IO3-达到最大量,故折线3的起点若从1.5出发至6.5结束,则细线3代表了n(IO3-)的变化;
当n(Cl2):n(FeI2)<1时,碘离子反应生成碘单质,碘离子浓度减小至1时为0,碘单质的浓度最大,为原来碘离子浓度的一半,所以1代表了n(I-)的变化,2代表了n(I2)的变化;
当1.5≥n(Cl2):n(FeI2)>1:1时,Fe2+浓度减少至1.5时,Fe2+达到最小量为0,故粗线4代表了n(Fe2+)的变化,然后结合发生的离子反应解答.
因此,当n(Cl2):n(FeI2)>1:1时,开始生成Fe3+至1.5时,Fe3+达到最大量,故粗线5代表了n(Fe3+)的变化;
当n(Cl2):n(FeI2)>1.5时,开始生成IO3-,至6.5时,IO3-达到最大量,故折线3的起点若从1.5出发至6.5结束,则细线3代表了n(IO3-)的变化;
当n(Cl2):n(FeI2)<1时,碘离子反应生成碘单质,碘离子浓度减小至1时为0,碘单质的浓度最大,为原来碘离子浓度的一半,所以1代表了n(I-)的变化,2代表了n(I2)的变化;
当1.5≥n(Cl2):n(FeI2)>1:1时,Fe2+浓度减少至1.5时,Fe2+达到最小量为0,故粗线4代表了n(Fe2+)的变化,然后结合发生的离子反应解答.
解答:解:A.当n(Cl2):n(FeI2)>1:1时,开始生成Fe3+至1.5时,Fe3+达到最大量,故粗线5代表了n(Fe3+)的变化,当n(Cl2):n(FeI2)>1.5时,开始生成IO3-,至6.5时,IO3-达到最大量,故折线3的起点若从1.5出发至6.5结束,则细线3代表了n(IO3-)的变化,故A正确;
B.由5Cl2+I2+6H2O=2IO3-+12H++10Cl-可知,随氯气的通入,酸性增强,pH减小,故B错误;
C.当n(Cl2):n(FeI2)=6.5时,氯气和碘化亚铁恰好反应,反应方程式为13Cl2+2FeI2+12H2O=2FeCl3+4HIO3+20HCl,则n(C1-):n(IO3-)=26:4=13:2=6.5,故C错误;
D.当n(Cl2):n(FeI2)=1.2时,碘离子全部被氧化,亚铁离子部分氧化,则离子反应为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-,故D正确;
故选AD.
B.由5Cl2+I2+6H2O=2IO3-+12H++10Cl-可知,随氯气的通入,酸性增强,pH减小,故B错误;
C.当n(Cl2):n(FeI2)=6.5时,氯气和碘化亚铁恰好反应,反应方程式为13Cl2+2FeI2+12H2O=2FeCl3+4HIO3+20HCl,则n(C1-):n(IO3-)=26:4=13:2=6.5,故C错误;
D.当n(Cl2):n(FeI2)=1.2时,碘离子全部被氧化,亚铁离子部分氧化,则离子反应为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-,故D正确;
故选AD.
点评:本题考查离子反应及氧化还原反应,把握氧化性、还原性强弱确定离子反应的先后顺序为解答的关键,明确每一条折线代表的物质及对应的反应即可解答,题目难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目