题目内容
将5.1g镁铝合金投入过量盐酸中充分反应,得到500mL溶液和5.6L标准状况下的H2。计算:
(1)合金中镁和铝的质量之比;
(2)所得溶液中Mg2+的物质的量浓度。
(1)8:9(2)0.2mol/L
解析试题分析:
解:(1)令镁、铝的物质的量分别为xmol、ymol,则:
Mg+2HCl=MgCl2+H2
x x
2Al+6HCl=2AlCl3+3H2
y 1.5y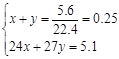

m(Mg):m(Al)=8:9
故m(Mg):m(Al)=24g/mol×0.1mol:27g/mol×0.1mol=8:9,
答:合金中镁和铝的质量之比为8:9
(2)n(Mg2+)=n(Mg)=0.1mol,故c(Mg2+)=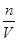 =
=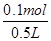 =0.2mol/L,
=0.2mol/L,
答:所得溶液中Mg2+的物质的量浓度为0.2mol/L。
考点:有关混合物反应的计算

钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击分解产生钠和氮气,故可应用于汽车安全气囊。若78克叠氮化钠完全分解,产生标准状况下氮气___________________L 。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。计算溶液中氢氧化钠的物质的量浓度______________________(忽略液体体积变化)。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应: 2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O。己知通入二氧化碳112 L(标准状况下),生成的Al(OH)3和Na2CO3的物质的量之比为4:5。若向该溶液中通入的二氧化碳为224L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量的最大值。
(4)为测定某硫酸吸收含氨气废气后,所得铵盐中氮元素的质量分数,现将不同质量的铵盐固体分别加入到50.00mL相同浓度的氢氧化钠溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表:
| 铵盐的质量/g | 10.00 | 20.00 | 30.00 | 50.00 |
| 浓硫酸增加的质量/g | m | m | 1.29 | 0 |
试回答:
该铵盐的成分为_______________________________。
该铵盐中氮元素的质量分数为:_______________________________(须列式计算)。
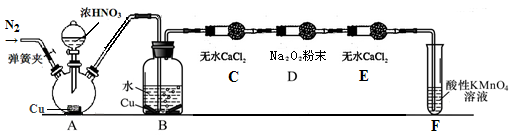
某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
实验:将燃烧的钠迅速伸入到盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。
提出假设
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
设计实验方案验证假设
该小组对燃烧后的白色产物
进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
| | ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
【思考与交流】
(1)甲同学认为方案1得到的结论不正确,其理由是 。
(2)乙同学认为方案2得到的结论正确,白色物质为 。
(3)通过方案1和方案2的实验,你认为上述三个假设中, 成立。你的理由是 。
(4)钠在二氧化碳中燃烧的化学方程式为 。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点?并简述理由: 。