题目内容
实验室有甲、乙两瓶丢失标签的无色溶液,其中一瓶是盐酸,另一瓶是碳酸钠溶液。为确定两瓶溶液的成分及其物质的量浓度,现操作如下:①量取25.00mL甲溶液,向其中缓缓滴加乙溶液15.00mL,共收集到CO2气体224mL(标准状况,下同)。
②另取15.00mL乙溶液,向其中缓缓滴加甲溶液25.00mL,共收集到CO2气体112mL。
(1)甲是______,甲溶液的物质的量浓度为_______,乙溶液的物质的量浓度为_______(二氧化碳的溶解忽略不计)。
(2)将amL甲溶液与等体积的乙溶液按各种可能的方式混合,产生的气体的体积为V(标准状况),则V的取值范围为________。
(1)盐酸;0.8mol?L-1;1mol?L-1。
(2)0mL≤V≤8.96amL。
【试题分析】
解析:由操作步骤①②可知:不论如何操作,Na2CO3不会完全转化为CO2,即盐酸不足量。由于①产生的CO2的体积比②产生的CO2的体积大,因此可以判断甲为盐酸,乙为Na2CO3溶液。
根据①发生的反应:2H++
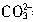 =CO2↑+H2O,由CO2的体积求出盐酸的物质的量浓度为:c(HCl)=
=CO2↑+H2O,由CO2的体积求出盐酸的物质的量浓度为:c(HCl)=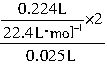 =0.8mol?L-1。
=0.8mol?L-1。根据②发生的反应:
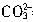 +H+=
+H+=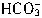 ,
,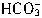 +H+=CO2↑+H2O,可利用CO2的体积求出生成CO2时消耗盐酸的量,
+H+=CO2↑+H2O,可利用CO2的体积求出生成CO2时消耗盐酸的量,再利用剩余盐酸的量求出Na2CO3的浓度为:c(Na2CO3)=
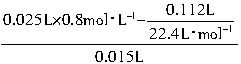 =1mol?L-1。
=1mol?L-1。由上述分析和计算可知:若将等体积的上述盐酸滴加到上述Na2CO3溶液中,只发生
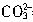 +H+=
+H+=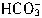 反应,而且只能将部分Na2CO3转化为NaHCO3,因此产生的CO2的体积最小为0;若将等体积(amL)的上述Na2CO3溶液滴加到上述盐酸中,此时发生2H++
反应,而且只能将部分Na2CO3转化为NaHCO3,因此产生的CO2的体积最小为0;若将等体积(amL)的上述Na2CO3溶液滴加到上述盐酸中,此时发生2H++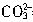 =CO2↑+H2O反应,产生的CO2的体积最大,其体积V=
=CO2↑+H2O反应,产生的CO2的体积最大,其体积V= ×22.4L?mol-1=8.96a×10-3L,即8.96amL。则V的取值范围为
×22.4L?mol-1=8.96a×10-3L,即8.96amL。则V的取值范围为0mL≤V≤8.96amL。

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目