题目内容
熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO32--52e-═34CO2+10H2O.试回答下列问题:
(1)该燃料电池的化学反应方程式为______.
(2)正极电极反应式为______.
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此,必须在通入的空气中加入一种物质,加入的物质是______.
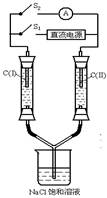
(4)某学生想用该燃料电池和如图所示装置来电解饱和食盐水.
①写出该反应的离子方程式______.
②若电解后得到200mL3.25mol/LNaOH溶液,则消耗C4H10的体积在标准状况下为______mL.
(1)该燃料电池的化学反应方程式为______.
(2)正极电极反应式为______.
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此,必须在通入的空气中加入一种物质,加入的物质是______.
(4)某学生想用该燃料电池和如图所示装置来电解饱和食盐水.
①写出该反应的离子方程式______.
②若电解后得到200mL3.25mol/LNaOH溶液,则消耗C4H10的体积在标准状况下为______mL.

(1)该电池中,丁烷和氧气反应生成二氧化碳和水,反应方程式为:2C4H10+13O2=8CO2+10H2O,
故答案为:2C4H10+13O2=8CO2+10H2O;
(2)正极上氧气得电子发生还原反应和二氧化碳反应生成碳酸根离子,电极反应式为:O2+2CO2+4e-=2CO32-或13O2+26CO2+52e-=26CO32-,
故答案为:O2+2CO2+4e-=2CO32-或13O2+26CO2+52e-=26CO32-;
(3)由于原电池的负极产物有水生成,所以负极必有CO32-参加反应,同时根据碳守恒可知A必为CO2,负极反应式可表示为CH4+4CO32--8e-=5CO2+2H2O,故答案为:CO2;
(4)①电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时还生成氢氧化钠,离子方程式为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
②氢氧化钠的物质的量=3.25mol/L×0.2L=0.65mol,根据2Cl-+2H2O
Cl2↑+H2↑+2OH-知,生成0.65mol氢氧化钠时转移电子的物质的量=
×2=0.65mol,串联电池中转移电子数相等,所以丁烷的体积=
×22.4L/mol=560mL,
故答案为:560.
故答案为:2C4H10+13O2=8CO2+10H2O;
(2)正极上氧气得电子发生还原反应和二氧化碳反应生成碳酸根离子,电极反应式为:O2+2CO2+4e-=2CO32-或13O2+26CO2+52e-=26CO32-,
故答案为:O2+2CO2+4e-=2CO32-或13O2+26CO2+52e-=26CO32-;
(3)由于原电池的负极产物有水生成,所以负极必有CO32-参加反应,同时根据碳守恒可知A必为CO2,负极反应式可表示为CH4+4CO32--8e-=5CO2+2H2O,故答案为:CO2;
(4)①电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时还生成氢氧化钠,离子方程式为:2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
②氢氧化钠的物质的量=3.25mol/L×0.2L=0.65mol,根据2Cl-+2H2O
| ||
| 0.65mol |
| 2 |
| 0.65mol |
| 6.5×4 |
故答案为:560.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 导线
导线