题目内容
氢氧化铜悬浊液中存在如下平衡:Cu(OH)2 (s)?Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)?c2(OH-)=
2×10-20mol2?L-2.
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于
(2)要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为
2×10-20mol2?L-2.
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于
5
5
.(2)要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为
6
6
.分析:(1)c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,根据Ksp计算pH;
(2)0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,c(Cu2+)=0.0002mol/L,根据Ksp计算pH.
(2)0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,c(Cu2+)=0.0002mol/L,根据Ksp计算pH.
解答:解:(1)Ksp=c(Cu2+)?[c(OH-)]2=2×10-20,c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,c(0H-)=
=10-9mol/L,c(H+)=10-5mol/L,所以pH=5,即生成Cu(OH)2沉淀,应调整溶液pH,使之大于5,故答案为:5;
(2)0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,c(Cu2+)=0.0002mol/L,c(0H-)=
=10-8mol/L,c(H+)=10-6mol/L,所以pH=6,故答案为:6.
|
(2)0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,c(Cu2+)=0.0002mol/L,c(0H-)=
|
点评:本题考查较综合,涉及化学平衡的计算、溶度积的计算及盐类水解等知识点,注重高考常考点的考查,侧重反应原理及学生计算能力的考查,题目难度中等.

练习册系列答案
相关题目
(6分) 氢氧化铜悬浊液中存在如下平衡:
Cu(OH)2 (s)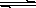 Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20则:
Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20则:
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于 。
(2)除去CuCl2溶液中少量的Fe2+,可以按照下面的流程进行:
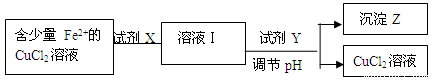
已知Fe2+ 、Cu2+ 、Fe3+ 三种离子开始沉淀和完全沉淀时溶液pH值如下:
|
金属 离子 |
pH |
|
|
开始沉淀 |
完全沉淀 |
|
|
Fe2+ |
7.6 |
9.6 |
|
Cu2+ |
4.4 |
6.4 |
|
Fe3+ |
2.7 |
3.7 |
①下列物质中适合作为试剂X的是
A.H2O2 B.KMnO4 C.HNO3 D.Cl2
②加入的Y及调节的pH范围是
A.CuCO3 3.7~4.3 B.CuO 3.7~6.4
C.NaOH 3.7~4.2 D.NH3·H2O 3.7~4.0