题目内容
硫酸银的溶解度较小,25℃时,每100g水仅溶解0.836g。
(1)25℃时,在烧杯中放入 6.24克硫酸银固体,加200克水,经充分溶解后,所得饱和溶液的体积为 200mL,计算溶液中Ag+的物质的量浓度。
(2)若在上述烧杯中加入50mL0.0268 mol/LBaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3)在(1)题烧杯中需加入多少L 0.0268 mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200 mol/L
(1)25℃时,在烧杯中放入 6.24克硫酸银固体,加200克水,经充分溶解后,所得饱和溶液的体积为 200mL,计算溶液中Ag+的物质的量浓度。
(2)若在上述烧杯中加入50mL0.0268 mol/LBaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3)在(1)题烧杯中需加入多少L 0.0268 mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200 mol/L
(1)0.0536 mol/L (2)0.0536 mol/L (3)0.489L
(1)25℃时,Ag2SO4的溶解度为0.836g,故200g水在25℃最多可溶解Ag2SO42×0.836=1.672g,即烧杯中加入6.24gAg2SO4实

0.0536mol/L。
(2)在烧杯中加入50mL,0.0268 mol/L BaCl2溶液后,由于发生反应:Ag2SO4+BaCl2=BaSO4↓+2AgCl↓,消耗了溶液中的Ag+和SO42-,使未溶解的Ag2SO4固体继续溶解。消耗的Ag2SO4质量为0.05×0.0268
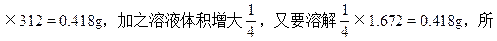
以共又溶解了0.418+0.418=0.836<6.24-1.672。即溶液仍为饱和溶液,所以溶液中[Ag+]=0.0536mol/L。
(2)假设烧杯中6.24g Ag2SO4被刚好溶解完,则溶液中Ag2SO4的物
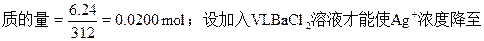
0.0200mol/L即Ag2SO4的浓度降至0.0100mol/L;
根据 Ag2SO4+BaCl2=2AgCl↓+BaSO4↓
0.0268V 0.0268V
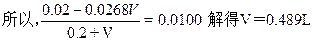

0.0536mol/L。
(2)在烧杯中加入50mL,0.0268 mol/L BaCl2溶液后,由于发生反应:Ag2SO4+BaCl2=BaSO4↓+2AgCl↓,消耗了溶液中的Ag+和SO42-,使未溶解的Ag2SO4固体继续溶解。消耗的Ag2SO4质量为0.05×0.0268
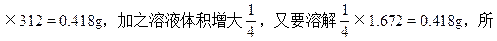
以共又溶解了0.418+0.418=0.836<6.24-1.672。即溶液仍为饱和溶液,所以溶液中[Ag+]=0.0536mol/L。
(2)假设烧杯中6.24g Ag2SO4被刚好溶解完,则溶液中Ag2SO4的物
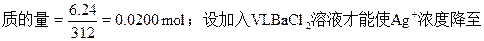
0.0200mol/L即Ag2SO4的浓度降至0.0100mol/L;
根据 Ag2SO4+BaCl2=2AgCl↓+BaSO4↓
0.0268V 0.0268V

练习册系列答案
相关题目
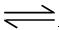 Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10 Ca2++2OH-
Ca2++2OH- Ba2+(aq)+ CrO42-(aq)的平衡体系中,加入BaCl2浓溶液沉淀量增多
Ba2+(aq)+ CrO42-(aq)的平衡体系中,加入BaCl2浓溶液沉淀量增多 )中的酚羟基,需加入适量的小苏打溶液后,再加入氯化铁溶液
)中的酚羟基,需加入适量的小苏打溶液后,再加入氯化铁溶液 氧化钙的悬浊液中,存在如下溶解平衡关系:
氧化钙的悬浊液中,存在如下溶解平衡关系: