题目内容
分析下列各氧化还原反应中各元素化合价的升降情况,指出各反应的氧化剂、还原剂:
(1)Fe+CuSO4=FeSO4+Cu
(2)2H2O 2H2↑+O2↑
2H2↑+O2↑
(3)CO2+C 2CO
2CO
(4)2H2S+SO2=2H2O+3S↓
(5)3S+6KOH=2K2S+K2SO3+3H2O
(1)Fe+CuSO4=FeSO4+Cu
(2)2H2O
 2H2↑+O2↑
2H2↑+O2↑(3)CO2+C
 2CO
2CO (4)2H2S+SO2=2H2O+3S↓
(5)3S+6KOH=2K2S+K2SO3+3H2O
(1)Fe:0→+2,Cu:+2→0;氧化剂和还原剂分别是CuSO4和Fe。
(2)H2O中H:+1→0,O:-2→0;H2O既做氧化剂又做还原剂。
(3)CO2中C:+4→+2,C:0→+2;氧化剂和还原剂分别是CO2和C。
(4)H2S中S:-2→0,SO2中S:+4→0;氧化剂和还原剂分别是SO2和H2S。
(5)S:0→-2和0→+4;S既做氧化剂又做还原剂。
(2)H2O中H:+1→0,O:-2→0;H2O既做氧化剂又做还原剂。
|
|
|
|
|
判断氧化还原反应中的氧化剂和还原剂主要看反应前后元素化合价的变化,有元素化合价升高的物质做还原剂,有元素化合价降低的物质做氧化剂。

练习册系列答案
相关题目
 2Fe+3CO2
2Fe+3CO2
 。
。 。
。 (标准状况) L。
(标准状况) L。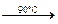 Cr2O3↓+2PbSO4↓+CH3CHO+O2↑+3H2O
Cr2O3↓+2PbSO4↓+CH3CHO+O2↑+3H2O