题目内容
在烧杯里加入20 mL 0.1 mol/L的Ba(OH)2溶液,再滴几滴酚酞 试液。然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液。实验装置如下图(夹 持仪器已去掉)
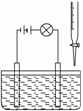
实验现象如下:
①灯泡逐渐变暗;
②烧杯中有白色沉淀生成,溶液红色变浅甚至消失。
请依据实验现象回答下列问题:
(1)灯泡变暗的原因是
______________________________________________________________________
________________________________________________________________________。
(2)有白色沉淀生成,说明
________________________________________________________________________。
红色变浅说明
________________________________________________________________________。
(3)当Ba2+恰好完全沉淀时,消耗NaHSO4溶液的体积为________mL,溶液呈______色,离子反应方程式为
________________________________________________________________________
________________________________________________________________________。
(4)若向(3)得到的溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为
________________________________________________________________________
________________________________________________________________________。
解析 Ba(OH)2与NaHSO4反应的方程式与滴入NaHSO4溶液的体积有关:
若使Ba2+完全沉淀,其离子方程式为:
Ba2++OH-+SO![]() +H+===BaSO4↓+H2O,
+H+===BaSO4↓+H2O,
此时消耗的NaHSO4溶液的体积为20 mL,此时OH-未完全反应。
若使溶液恰好变为无色,即OH-与H+恰好完全反应,其离子反应的方程式为:H++
OH-===H2O。
答案 (1)溶液中可自由移动的离子浓度变小
(2)Ba2+和SO![]() 发生了反应 H+和OH-发生了反应,使溶液碱性减弱
发生了反应 H+和OH-发生了反应,使溶液碱性减弱
(3)20 浅红 Ba2++OH-+SO![]() +H+===BaSO4↓+H2O (4)H++OH-===H2O
+H+===BaSO4↓+H2O (4)H++OH-===H2O

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案






 2NH3(g);
2NH3(g);