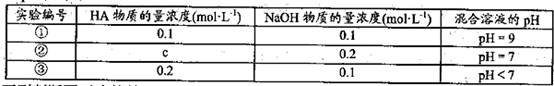
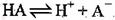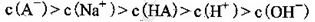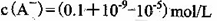题目内容
某二元酸(H2A)在水中的电离方程式为:H2A = H+ + HA- HA- H+ + A2- (Ka=1.0×10-2),下列说法正确的是
H+ + A2- (Ka=1.0×10-2),下列说法正确的是
A.在0.1 mol·L-1的H2A溶液中,c(H+)> 0.12 mol·L-1
B.在0.1 mol·L-1的Na2A溶液中,c(A2-)+ c(HA-)+ c(Na+)=" 0.2" mol·L-1
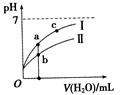
C.分别将同浓度(0.1 mol·L-1)的NaHA和Na2A溶液等体积混合,其pH一定小于7
D.0.1 mol·L-1的NaHA溶液中离子浓度为:c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-)
 H+ + A2- (Ka=1.0×10-2),下列说法正确的是
H+ + A2- (Ka=1.0×10-2),下列说法正确的是A.在0.1 mol·L-1的H2A溶液中,c(H+)> 0.12 mol·L-1
B.在0.1 mol·L-1的Na2A溶液中,c(A2-)+ c(HA-)+ c(Na+)=" 0.2" mol·L-1
C.分别将同浓度(0.1 mol·L-1)的NaHA和Na2A溶液等体积混合,其pH一定小于7
D.0.1 mol·L-1的NaHA溶液中离子浓度为:c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-)
C
试题分析:A. 在0.1 mol·L-1的H2A溶液中,首先发生电离:H2A = H+ + HA- ,这步是完全的、彻底的,然后发生电离:HA-
 H+ + A2-。由于第一步的电离对第二步的电离起抑制作用,所以c(H+)< 0.12 mol·L-1。错误。B. 在0.1 mol·L-1的Na2A溶液中,根据物料守恒可得c(A2-)+ c(HA-)+ c(Na+)= 0.3mol·L-1.错误。C. 由于在NaHA的溶液中存在HA-
H+ + A2-。由于第一步的电离对第二步的电离起抑制作用,所以c(H+)< 0.12 mol·L-1。错误。B. 在0.1 mol·L-1的Na2A溶液中,根据物料守恒可得c(A2-)+ c(HA-)+ c(Na+)= 0.3mol·L-1.错误。C. 由于在NaHA的溶液中存在HA- H+ + A2- (Ka=1.0×10-2)将同浓度(0.1 mol·L-1)的NaHA和Na2A溶液等体积混合,由于HA-的电离作用大于水解作用,所以其pH一定小于7。正确。D. 在0.1 mol·L-1的NaHA溶液中,HA-会发生电离作用,所以c(Na+)>c(HA-);电离 使 溶 液 显 酸 性,c(H+)>c(OH-);但是HA-的电离作用是微弱的,而且在溶液中还存在水的电离作用,因此c(HA-)>c(H +)>c(A2-)。故溶液中的离子浓度的关系是c(Na+)>c(HA-)>c(H +)>c(A2-)>c(OH-)。错误。
H+ + A2- (Ka=1.0×10-2)将同浓度(0.1 mol·L-1)的NaHA和Na2A溶液等体积混合,由于HA-的电离作用大于水解作用,所以其pH一定小于7。正确。D. 在0.1 mol·L-1的NaHA溶液中,HA-会发生电离作用,所以c(Na+)>c(HA-);电离 使 溶 液 显 酸 性,c(H+)>c(OH-);但是HA-的电离作用是微弱的,而且在溶液中还存在水的电离作用,因此c(HA-)>c(H +)>c(A2-)。故溶液中的离子浓度的关系是c(Na+)>c(HA-)>c(H +)>c(A2-)>c(OH-)。错误。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


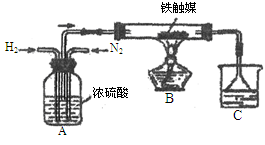
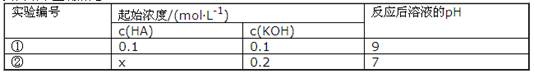
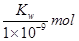 ·L-1
·L-1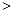 0.1mol·L-l
0.1mol·L-l