题目内容
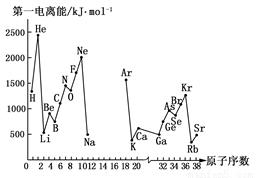
 第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失).
第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失).请回答以下问题:
(1)认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小(最小)范围为
Na
Na
<Al<Mg
Mg
(填元素符号).(2)从图分析可知,同一主族元素原子的第一电离能I1变化规律是
从上到下依次减小
从上到下依次减小
.(3)图中第一电离能最小的元素在周期表中的位置是
第五周期ⅠA族
第五周期ⅠA族
.(4)根据对角线规则,Be、Al元素最高氧化物的水化物性质相似,它们都具有
两性
两性
,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O
Be(OH)2+2H+=Be2++2H2O
、Be(OH)2+2OH-=BeO2-+2H2O
Be(OH)2+2OH-=BeO2-+2H2O
.分析:(1)由图可知第ⅡA、ⅤA族元素的第一电离能有突变,因此Al的第一电离能的最小范围为Na<Al<Mg.
(2)同一主族元素原子的第一电离能I1变化规律是从上到下逐渐减小.
(3)图中第一电离能最小的元素是铷,在第五周期ⅠA族.
(4)Be(OH)2、Al(OH)3均为两性氢氧化物.
(2)同一主族元素原子的第一电离能I1变化规律是从上到下逐渐减小.
(3)图中第一电离能最小的元素是铷,在第五周期ⅠA族.
(4)Be(OH)2、Al(OH)3均为两性氢氧化物.
解答:解:(1)由图可知第ⅡA、ⅤA族元素的第一电离能有突变,因此Al的第一电离能的最小范围为Na<Al<Mg,故答案为:Na、Mg.
(2)同一主族元素原子的从上到下,金属性增强,容易失去电子,所以第一电离能I1变化规律是从上到下逐渐减小,故答案为:从上到下依次减小;
(3)金属性越强,越容易失去电子,所以第一电离能越小,图中第一电离能最小的元素是铷,在第五周期ⅠA族,故答案为:第五周期ⅠA族;
(4)Be(OH)2、Al(OH)3均为两性氢氧化物,都能与酸反应生成盐和水,也都能与强碱反应生成盐和水,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O
Be(OH)2+2OH-=BeO2-+2H2O;故答案为:两性;Be(OH)2+2H+=Be2++2H2O,Be(OH)2+2OH-=BeO2-+2H2O.
(2)同一主族元素原子的从上到下,金属性增强,容易失去电子,所以第一电离能I1变化规律是从上到下逐渐减小,故答案为:从上到下依次减小;
(3)金属性越强,越容易失去电子,所以第一电离能越小,图中第一电离能最小的元素是铷,在第五周期ⅠA族,故答案为:第五周期ⅠA族;
(4)Be(OH)2、Al(OH)3均为两性氢氧化物,都能与酸反应生成盐和水,也都能与强碱反应生成盐和水,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O
Be(OH)2+2OH-=BeO2-+2H2O;故答案为:两性;Be(OH)2+2H+=Be2++2H2O,Be(OH)2+2OH-=BeO2-+2H2O.
点评:本题考查了第一电离能的变化趋势,难度不大,注意“同一周期元素中,元素第一电离能的变化趋势,及异常现象”,为易错点.

练习册系列答案
相关题目
 主族元素
主族元素 )最近的C(用 表示)的位置.
)最近的C(用 表示)的位置.