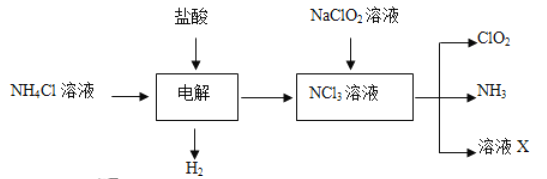
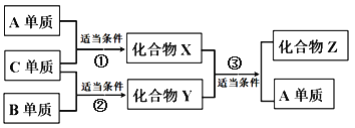
��Ŀ����
����Ŀ��ij��ѧʵ��С���ͬѧΪ̽���ͱȽ�SO2����ˮ��Ư���ԣ���������µ�ʵ��װ�ã� 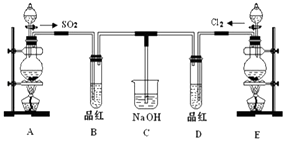
��1��ʵ������װ��A�Ʊ�SO2 �� ijͬѧ��ʵ��ʱ���ִ�A�ķ�Һ©��������©����Һ��δ���£�����Ϊԭ������� ��
��2��ʵ������װ��E�Ʊ�Cl2 �� �䷴Ӧ�����ӷ���ʽΪ������6mol��HCl�μӷ�Ӧ����ת�Ƶĵ�������Ϊ ��
��3��ֹͣͨ�����ٸ�B��D�����Թֱܷ���ȣ������Թ��е�����ֱ�ΪB�� �� D�� ��
��4����һ��ʵ��С���ͬѧ��ΪSO2����ˮ����Ư���ԣ�����Ϻ��Ư���Կ϶����ǿ�����ǽ��Ƶõ�SO2��Cl2��1��1ͬʱͨ�뵽Ʒ����Һ�У����������ɫЧ���������������������������������ԭ���û�ѧ����ʽ��ʾ�� ��
���𰸡�
��1����Һ©���IJ�����û��ȡ����
��2��MnO2+4H++2Cl�� ![]() Mn2++2H2O+Cl2����3��6.02��1023
Mn2++2H2O+Cl2����3��6.02��1023
��3����ɫ��Ʒ���ָֻ��ɺ�ɫ����Һû�����Ա仯
��4��SO2+Cl2+2H2O=H2SO4+2HCl
���������⣺��1������û��ȡ����������ʱ�������������Һ©���ڲ�����ɷ�Һ©���ڵ�ѹǿС�ڴ���ѹǿ��Һ�����������ʴ�Ϊ����Һ©���IJ�����û��ȡ��������2��ʵ������װ��E�Ʊ�Cl2 �� ����ȣ�Ϊ�������̺�Ũ����ķ�Ӧ������������ѧ��ӦΪMnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O�����ӷ�ӦΪ��MnO2+4H++2Cl��
MnCl2+Cl2��+2H2O�����ӷ�ӦΪ��MnO2+4H++2Cl�� ![]() Mn2++2H2O+Cl2������MnO2+4HCl��Ũ��
Mn2++2H2O+Cl2������MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��ÿ��4mol HCl���뷴Ӧ�����������Ȼ�����2mol�������������Ȼ���ռ���뷴Ӧ��50%��6 molHCl�μӷ�Ӧ���������Ȼ�����3mol��ת�Ƶĵ�����Ϊ3NA=3��6.02��1023 �� �ʴ�Ϊ��MnO2+4H++2Cl��
MnCl2+Cl2��+2H2O��ÿ��4mol HCl���뷴Ӧ�����������Ȼ�����2mol�������������Ȼ���ռ���뷴Ӧ��50%��6 molHCl�μӷ�Ӧ���������Ȼ�����3mol��ת�Ƶĵ�����Ϊ3NA=3��6.02��1023 �� �ʴ�Ϊ��MnO2+4H++2Cl�� ![]() Mn2++2H2O+Cl2����3��6.02��1023����3���������Ư�����������Եģ����������Ư��������ʱ�ģ�����ʱ��������Ư������Һ�ޱ仯�������������ɫ�������ɵ���ɫ���ʲ��ȶ�������ʱ���ɺ�ɫ���ʴ�Ϊ����ɫ��Ʒ���ָֻ��ɺ�ɫ����Һû�����Ա仯����4���������������������ʵ�����Ӧ������������ᣬ��������ᶼ������Ư���ԣ���ѧ����ʽΪ��SO2+Cl2+2H2O=H2SO4+2HCl���ʴ�Ϊ��SO2+Cl2+2H2O=H2SO4+2HCl��
Mn2++2H2O+Cl2����3��6.02��1023����3���������Ư�����������Եģ����������Ư��������ʱ�ģ�����ʱ��������Ư������Һ�ޱ仯�������������ɫ�������ɵ���ɫ���ʲ��ȶ�������ʱ���ɺ�ɫ���ʴ�Ϊ����ɫ��Ʒ���ָֻ��ɺ�ɫ����Һû�����Ա仯����4���������������������ʵ�����Ӧ������������ᣬ��������ᶼ������Ư���ԣ���ѧ����ʽΪ��SO2+Cl2+2H2O=H2SO4+2HCl���ʴ�Ϊ��SO2+Cl2+2H2O=H2SO4+2HCl��
A�����Ʊ�SO2 �� ����Na2SO3�����ᷴӦ��ȡ��B���ڼ��������������ɣ�E��Ũ����Ͷ��������ڼ����������Ʊ�������D���ڼ��������Ư���ԣ�C��������β������1��ʹ�÷�Һ©��ʱӦȡ�����ӣ�ʹ��Һ©���ڵ�ѹǿ���ڴ���ѹǿ����֤Һ��˳����������2��ʵ������װ��E�Ʊ�Cl2 �� Ϊ�������̺�Ũ����ķ�Ӧ�������������ݻ��ϼ۵ı仯����ת�Ƶĵ�����Ŀ����3��SO2��Ư���п����ԣ��������Ư�ײ����棻��4���������н�ǿ�������ԣ�����������н�ǿ�Ļ�ԭ�ԣ��������������������ʵ�����Ӧ������������ᣬ��������ᶼ������Ư���ԣ�

 �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д� �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д�����Ŀ����������ʵ���ʵ��������������ý�����ȷ���ǣ�
ѡ�� | ʵ���ʵ����� | ���� | ʵ����� |
A | �ô���ʯ�����ᷴӦ��������������ͨ��һ��Ũ�ȵ�Na2SiO3 ��Һ�� | ���ְ�ɫ���� | H2CO3�����Ա�H2SiO3������ǿ |
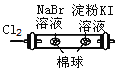
B | ��ij��Һ�ȵμ������ữ���ٵμ�BaCl2��Һ | �а�ɫ�������� | ԭ��Һ�к���SO42-��SO32-��HSO3-�е�һ�ֻ��� |
C |
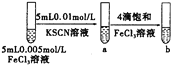
| �Թ�b���Թ�a����Һ�ĺ�ɫ�� | ����Ӧ��Ũ�ȣ�ƽ��������Ӧ�����ƶ� |
D |
| ��������Ϊ��ɫ���ұ������Ϊ��ɫ | �����ԣ�Cl2��Br2��I2 |
A. A B. B C. C D. D