题目内容
测定硫酸铜晶体(CuSO4·5H2O)结晶水含量的实验步骤为:①研磨;②称量空坩埚和装有试样的坩埚的质量;③加热;④冷却;⑤称量;⑥重复③—⑤的操作,直到连续两次称量的质量差不超过请回答下列问题:
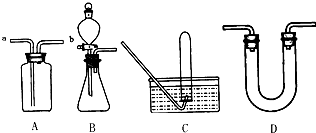
(1)从以下仪器中选出本实验不需要使用的仪器(用字母填写)_______________。
A.托盘天平 B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚 H.干燥器 I.泥三角 J.石棉网 K.三脚架 L.药匙 M.坩埚钳
(2)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?
答:___________________________________。
(3)做此实验,至少应进行称量操作_______________次,至少加热_______________次。
(4)实验步骤⑥的目的是_____________________________________________。
(5)实验后得到以下数据:
①加热前质量:W1(容器),W2(容器+晶体);②加热后质量:W3(容器+无水硫酸铜)。
请写出硫酸铜晶体中结晶水含量,用质量分数表示的计算式(含W1、W2、W3)为:_____________。
(6)若操作正确但实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有____________。
A.被测样品中含有加热不挥发的杂质
B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水
D.加热前所用的坩埚未完全干燥
解析:题目要求测定硫酸铜晶体中结晶水的含量,关键是要测定出一定质量的硫酸铜晶体中结晶水的质量。然后用下式求算:
结晶水的含量=![]() ×100%。
×100%。
所以,凡是能引起m(H2O)减小的操作都能使测量结果偏低。(6)中A、C两种情况下测量结果肯定偏低,B、D两种情况则会使结果偏高。
m(H2O)是实验前后固体质量差,因此每次实验操作就必须考虑到操作的精确性。实验步骤⑥的目的就是检验样品中的结晶水是否已经全部失去。
从题目信息我们不难看出,m(H2O)=W2-W3,m(硫酸铜晶体)=W2-W1。则:
样品中结晶水的含量为:![]() ×100%。
×100%。
答案:(1)CEJ
(2)冷却(或④);防止吸水
(3)4 2
(4)检验样品中的结晶水是否已经全部失去
(5)![]() ×100%
×100%
(6)AC

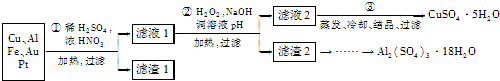
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到主要含Cu、Al及少量Fc、Au、Pt等金属的混合物,设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
|
沉淀物 |
Fe( OH)2 |
Fe( OH)3 |
Al( OH)3 |
Cu( OH)2 |
|
开始沉淀 |
5.8 |
1.1 |
4.0 |
5.4 |
|
完全沉淀 |
8.8 |
3.2 |
5.2 |
6.7 |
请回答下列问题:
(1)第①步操作前需将金属混合物进行粉碎,其目的是 ;
(2)某学生认为用H2O2代替浓HNO3更好,理由是 ;
请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式是 。
(3)第②步中应将溶液pH调至 。
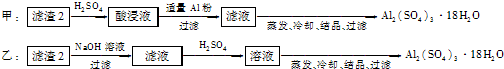
(4)由滤渣2制取Al2( SO4)3.18H2O,探究小组设计了两种方案:

你认为 种方案为最佳方案,理由是 、 。
(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成l00mL溶液,取l0m溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.l000mol·L-1Na2S2O3标准溶液滴定至终点,共消耗14. 00mL Na2S2O3标准溶液。上述过程中反应的离子方程式如下:
2Cu2+ +4I-=2CuI(白色)↓+I2
2S2O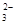 +I2=
2I-+S4O
+I2=
2I-+S4O
①样品中硫酸铜晶体的质量分数为____ 。
②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是 。