题目内容
(1)0.1 mol/L盐酸和0.06 mol/L Ba(OH)2溶液按等体积混合溶液的pH等于多少?
(2)用pH=4和pH=11的强酸和弱碱混合,使pH=10,求两溶液的体积比?
解析:
|
(1)根据盐酸和Ba(OH)2间反应的物质的量之比可知:0.1 mol HCl可和0.05 mol Ba(OH)2完全中和.所以剩余0.01 mol Ba(OH)2,即余下0.02 mol OH-.此时溶液中c(OH-)=0.02/2=0.01(mol/L),pOH=2,pH=12.或c(H+)=Kw/c(OH-)=1×10-14/0.01=1×10-2(mol/L),∴pH=12 (2)pH=4,c(H+)=1×10-4 mol/L,设其体积为V1.pH=11,c(OH-)=1×10-3 mol/L,设其体积为V2.混合后pH=10,c(OH-)=1×10-4 mol/L,可以预见碱多酸少符合题意,故可得下式: (V2×10-3-V1×10-4)/(V1+V2)=10-4 V2×10-3-V1×10-4=V1×10-4+V2×10-4 V1(2×10-4)=V2(10-3-10-4) V1(2×10-4)=V2(9×10-4) 得:2V1=9V2即V1/V2=9/2 |
提示:
|
求强酸强碱间的不完全中和的pH或溶液的体积比是该部分的基本计算,关键是确定过量的是何种物质,酸过量只能求c(H+),碱过量中能先求出c(OH-),再求出pH. |

 字词句段篇系列答案
字词句段篇系列答案工业碳酸钠由于在生产过程中原料盐和工艺等的原因,常会含有Na2SO4 、NaCl中的一种或两种杂质。现有工业碳酸钠样品,某化学兴趣小组就工业碳酸钠中是否含有这两种杂质进行探究。实验室有以下的仪器和药品可供使用:
烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:1.0 mol·L-1H2SO4、1.0 mol·L-1HNO3、1.0mol·L-1HCl、NaOH稀溶液、0.1 mol·L-1AgNO3、0.1 mol·L-1BaCl2 、0.1 mol·LBa(NO3)2、蒸馏水。以下是部分实验探究过程:
1)提出假设:
假设1 白色粉末为 的混合物;
假设2 白色粉末为 的混合物;
假设3 白色粉末为碳酸钠、硫酸钠、氯化钠的混合物;
2)基于假设设计实验方案
3)根据实验方案进行实验
请回答:
(1)某同学取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1 mol·L-1的BaCl2溶液,有白色沉淀产生,他认为样品中含有Na2SO4。你认为他的结论是 (填“对的”或“错的”),原因是: 。
(2)设计实验方案
基于工业碳酸钠中两种杂质均存在这一假设,设计出实验方案(在答题卡上作答)。
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 有无色气体产生,说明样品中含有Na2CO3。 若无气体产生,说明样品中没有Na2CO3。 | |
| ② | ||
| ③ |
常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
|
序号 |
a |
b |
c |
d |
e |
f |
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
NaAlO2 |
|
pH |
8. 8 |
9. 7 |
11. 6 |
10. 3 |
11. 1 |
11. 3 |
(1)上述溶液中的阴离子结合H+能力最弱的为 。(填阴离子化学式)
(2)NaAlO2溶液呈碱性的原因是 (用离子方程式表示)。将溶液加热蒸干最后得到的固体产物是 ;
(3)结合表中数据分析, 与0. 1 mol/L的CH3COONa溶液中水的电离程度相同的有 (填字母代号)。
A.pH=8. 8的NaOH溶液 B. pH=5. 2的NH4Cl溶液 C.pH=5. 2的盐酸
D. 0. 1 mol/L的NaCN溶液 E.pH=8. 8的Na2CO3溶液
(4)将浓度均为0. 1 mol/L的b、c等体积混合, 所得溶液中各离子浓度关系正确的有 。
A.c(Na+)= c(CO32-) +c(HCO3-) +c(H2CO3)
B. 2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3)
C. c(OH-)= c(H+) +c(HCO3-) +2c(H2CO3)
D. c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
E. c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+)
F. c(Na+)> c(CO32-) > c(HCO3-) > c(H+)> c(OH-)
(5)0.2 mol/LHCl与0.1 mol/L NaAlO2溶液等体积混合溶液后离子浓度顺序为 。
(1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
①该反应的化学平衡常数的表达式K = ,由上表数据可得,该反应为 反应。(填“吸热”或“放热”)
②800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01 mol·L-1、c(H2O)=0.03 mol·L-1、c(CO2)=0.01 mol·L-1、c(H2)=0.05 mol·L-1,则反应开始时,H2O的消耗速率比生成速率 (填"大"、"小"或"不能确定")
③830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

①平衡时CH3OH的体积分数w为 。
②现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。下列说法正确的是
|
容器 |
实验1 |
实验2 |
实验3 |
|
反应物投入量(始态) |
1mol CO2、3mol H2 |
1mol CH3OH、1mol H2O |
2mol CH3OH、2mol H2O |
|
CH3OH的平衡浓度/mol·L-1 |
C1 |
C2 |
C3 |
|
反应的能量变化 |
放出 x kJ |
吸收y kJ |
吸收z kJ |
|
体系压强/Pa |
P1 |
P2 |
P3 |
|
反应物转化率 |
a1 |
a2 |
a3 |
A.2 C1>C3 B.x+y=49.0 C.2P2< P3
D.(a1+ a3)<1 E.2P1> P3 F.a1= a2
③在一个装有可移动活塞的容器中进行上述反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小
。
CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小
。
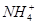 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)